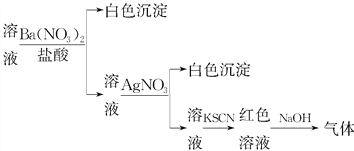
题目内容
【题目】4种相邻的主族短周期元素的相对位置如表,元素x的原子核外电子数是m的2倍,y的氧化物具有两性。回答下列问题:
m | n | ||
x | y |
(1)元素x在周期表中的位置是第_____周期、第____族,其单质可采用电解熔融的_____方法制备。
(2)m、n、y三种元素最高价氧化物的水化物中,酸性最强的是______,碱性最强的是______.(填化学式)
(3)气体分子(mn)2的电子式为_______,(mn)2称为拟卤素,性质与卤素类似,其与氢氧化钠溶液反应的化学方程式是_____________________________。
【答案】(1)第三周期第ⅡA族;MgCl2;(2)HNO3、Al(OH)3;
(3)![]() (CN)2+2NaOH=NaCN+NaCNO+H2O.
(CN)2+2NaOH=NaCN+NaCNO+H2O.
【解析】本题是元素及化合物推断试题。首先要了解短周期元素是那些元素;掌握元素的位置、结构、性质的关系。最后根据各元素的相对位置确定元素,再利用元素周期律一一解答。根据题意可得x是Mg;y是Al;m是C;n是N. (1)元素Mg在周期表中的位置是第三周期第ⅡA族,金属的冶炼方法与金属的活动性强弱有关。特别活泼的金属用电解法冶炼;比较活泼的金属用热还原法冶炼;不活泼的金属用热分解非冶炼。Mg是活泼的金属,在工业上一般用电解熔融的含Mg2+的化合物的方法获得。Mg在工业上采用电解熔融的MgCl2的方法制取。(2)元素的非金属性越强,其最高价氧化物对应的水化物的酸性就越强,元素的金属性越强,其最高价氧化物对应的水化物的碱性就越强,所以酸性强弱顺序是HNO3> H2CO3>Al(OH)3. 酸性最强的是HNO3。氢氧化铝是两性氢氧化物,既有酸性,也有碱性,因此碱性最强的是Al(OH)3。(3)气体分子(CN)2是共价化合物,两个C原子间共用一对电子对,C原子与N原子间共用三对电子对。它的电子式为![]() 。(CN)2是拟卤素,拟卤素性质与卤素类似。根据氯气与氢氧化钠反应的规律,可得(CN)2与NaOH反应的方程式是:(CN)2+2NaOH= NaCN+ NaCNO+H2O.
。(CN)2是拟卤素,拟卤素性质与卤素类似。根据氯气与氢氧化钠反应的规律,可得(CN)2与NaOH反应的方程式是:(CN)2+2NaOH= NaCN+ NaCNO+H2O.

【题目】25 ℃时某些弱酸的电离平衡常数如下表所示:
CH3COOH | HClO | H2CO3 |
K(CH3COOH) =1.8×10-5 | K(HClO) =3.0×10-8 | K(H2CO3)a1=4.4×10-7 K(H2CO3)a2=4.7×10-11 |
常温下,稀释CH3COOH、HClO两种酸时,溶液的pH随加水量变化的曲线如图所示,下列说法正确的是( )
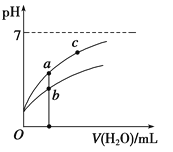
A.相同浓度的CH3COOH和HClO的混合溶液中,各离子浓度的大小关系是:
c(H+)>c(ClO-)>c(CH3COO-)>c(OH-)
B.图像中a、c两点所处的溶液中![]() 相等(HR代表CH3COOH或HClO)
相等(HR代表CH3COOH或HClO)
C.图像中a点酸的浓度大于b点酸的浓度
D.向NaClO溶液中通入少量二氧化碳的离子方程式为:2ClO-+CO2+H2O=2HClO+CO32—