题目内容
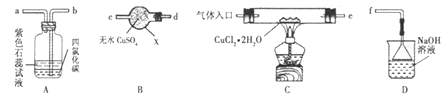
【题目】氯化亚铜(CuCl)在有机合成工业中常作催化剂。它是一种白色固体,微溶于水,易被空气中的氧气氧化。某研究性学习小组先在HCl气流中微热分解CuCl2·2H2O制无水CuCl2,再加热制备CuCl,并用下图所示装置进行相关实验探究(夹持仪器略)。
请回答下列问题:
(1)仪器X的名称是_________,装置连接顺序是 接_____、_____接_____、_____接f。
(2)实验操作的先后顺序是①→_____→_____→_____→⑤(填操作的编号)。
①检查装置的气密性后加入药品 ②熄灭酒精灯,冷却 ③在“气体入口”处通入干燥HCl
④点燃酒精灯,加热 ⑤停止通入HCl,然后通入N2其中通入N2气体的目的是________。
(3)在实验过程中,观察到B中物质由白色变为蓝色,A中上层溶液的颜色变化是______,下层CCl4的作用是①吸收少量Cl2;②________。
(4)装置D中发生的氧化还原反应的离子方程式为________。
(5)反应结束后,取出CuCl产品进行实验,发现其中含有少量的CuO杂质,则产生的原因___________。
【答案】干燥管dcba③④②让氯化亚铜在氮气流中冷却,防止氯化亚铜被氧化先变红,后褪色防止发生倒吸Cl2+2OH-=Cl-+ClO-+H2O通入HCl的量不足
【解析】
分析:(1)根据仪器X的结构特点回答;(2)本题主要考查盐的水解,加热分解CuCl2·2H2O制无水CuCl2,为防止被氧气氧化及Cu2+水解,必须先通入氯化氢气体把空气赶出。(3)本小题主要考查物质水、氯气等物质的检验。氯气难溶于四氯化碳,可以防止氯化氢气体溶于水发生倒吸;(4)本小题主要考查氯气的尾气处理,D中是Cl2和NaOH反应生成氯化钠、次氯酸钠和水;
本小题主要考查盐的水解,杂质是氧化铜,说明CuCl2水解生成Cu2(OH)2Cl2,进一步分解生成CuO;
解答:(1). X是干燥管;B中物质检验水生成,A中物质检验产物中还有Cl2生成,D尾气处理,装置连接顺序是 e接d、c接b、a接f;(2)为防止被氧气氧化及Cu2+水解,必须先通入氯化氢气体把空气赶出,且在氯化氢气流中加热,反应结束后要先停止加热,再在氮气的氛围中冷却后停止通氮气。实验操作的先后顺序是①检查装置的气密性后加入药品→③在“气体入口” 处通入干燥HCl→④点燃酒精灯,加热→②熄灭酒精灯,冷却→⑤停止通入HCl,然后通入N2;通入N2气体的目的是让氯化亚铜在氮气流中冷却,防止氯化亚铜被氧化 ;(3)在实验过程中有氯气生成, A中上层石蕊溶液的颜色变化是先逐渐变为红色再褪色,下层CCl4的作用是①吸收少量Cl2;②防倒吸。
(4)D中是Cl2和NaOH反应生成氯化钠、次氯酸钠和水,反应的离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O。
(5)杂质是氧化铜,说明CuCl2水解生成Cu2(OH)2Cl2,进一步分解生成CuO,原因是通入HCl的量不足,答案为:通入HCl的量不足;

【题目】25 ℃时某些弱酸的电离平衡常数如下表所示:
CH3COOH | HClO | H2CO3 |
K(CH3COOH) =1.8×10-5 | K(HClO) =3.0×10-8 | K(H2CO3)a1=4.4×10-7 K(H2CO3)a2=4.7×10-11 |
常温下,稀释CH3COOH、HClO两种酸时,溶液的pH随加水量变化的曲线如图所示,下列说法正确的是( )
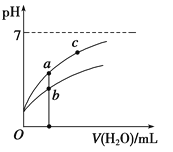
A.相同浓度的CH3COOH和HClO的混合溶液中,各离子浓度的大小关系是:
c(H+)>c(ClO-)>c(CH3COO-)>c(OH-)
B.图像中a、c两点所处的溶液中![]() 相等(HR代表CH3COOH或HClO)
相等(HR代表CH3COOH或HClO)
C.图像中a点酸的浓度大于b点酸的浓度
D.向NaClO溶液中通入少量二氧化碳的离子方程式为:2ClO-+CO2+H2O=2HClO+CO32—