题目内容
【题目】下列叙述正确的是
A.液态氯化氢、固体氯化钾均不导电,故HCl和KCl均为非电解质
B.SO2、SO3水溶液都能导电,故二者均为电解质
C.铜和石墨均能导电,所以它们都是电解质
D.蔗糖、乙醇在水溶液中和熔融状态下都不导电,所以它们是非电解质
【答案】D
【解析】
试题分析:A.液态氯化氢、固体氯化钾均不导电,但溶于水可以得到,HCl和KCl均为电解质,A错误;B.SO2、SO3水溶液都能导电,但二者均不能电离出离子,二者均为非电解质,B错误;C.铜和石墨均能导电,二者均是单质,所以它们不是电解质,也不是非电解质,C错误;D.蔗糖、乙醇在水溶液中和熔融状态下都不导电,所以它们是非电解质,D正确,答案选D。

【题目】下表是元素周期表的一部分,针对表中的①~⑧种元素,填写下列空白:
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
2 | ① | ② | ③ | ④ | |||
3 | ⑤ | ⑥ | ⑦ | ⑧ |
(1)在最高价氧化物的水化物中,酸性最强的化合物的名称是______,碱性最强的化合物的化学式是_______。
(2)⑤⑦形成化合物的电子式___。②形成的最高价氧化物的结构式____。
(3)最高价氧化物是两性氧化物的元素其元素符号是____;写出它的氢氧化物与⑧的最高价氧化物的水化物反应的离子方程式________。
(4)⑥的单质与⑤的最高价氧化物的水化物反应的离子方程式是______。
(5)②和⑦可形成原子数1∶2的液态化合物甲,并能溶解⑦的单质,用电子式表示甲的形成过程:____________。
【题目】25 ℃时某些弱酸的电离平衡常数如下表所示:
CH3COOH | HClO | H2CO3 |
K(CH3COOH) =1.8×10-5 | K(HClO) =3.0×10-8 | K(H2CO3)a1=4.4×10-7 K(H2CO3)a2=4.7×10-11 |
常温下,稀释CH3COOH、HClO两种酸时,溶液的pH随加水量变化的曲线如图所示,下列说法正确的是( )
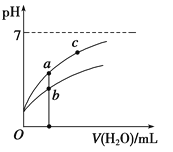
A.相同浓度的CH3COOH和HClO的混合溶液中,各离子浓度的大小关系是:
c(H+)>c(ClO-)>c(CH3COO-)>c(OH-)
B.图像中a、c两点所处的溶液中![]() 相等(HR代表CH3COOH或HClO)
相等(HR代表CH3COOH或HClO)
C.图像中a点酸的浓度大于b点酸的浓度
D.向NaClO溶液中通入少量二氧化碳的离子方程式为:2ClO-+CO2+H2O=2HClO+CO32—