题目内容
【题目】为消除NOx对大气的污染,工业上通常利用如下反应:NOx+NH3=N2+ H2O来保护环境。现有NO2和NO的混合气体5 L,可用相同状况下6 LNH3恰好使其完全转化成N2。则混合气体中NO2和NO的体积之比为
A. 1:4 B. 2 : 1 C. 3:1 D. 4:1
【答案】D
【解析】NO2和NO的混合气体与NH3反应生成N2与H2O,可以表示为5NOx+6NH3→5.5N2+9H2O,则x=1.8,设假设NO2和NO的物质的量分别为xmol、ymol,则:(2x+y)/(x+y)=1.8,整理可得x:y=4:1,答案选D。

练习册系列答案
相关题目
【题目】25 ℃时某些弱酸的电离平衡常数如下表所示:
CH3COOH | HClO | H2CO3 |
K(CH3COOH) =1.8×10-5 | K(HClO) =3.0×10-8 | K(H2CO3)a1=4.4×10-7 K(H2CO3)a2=4.7×10-11 |
常温下,稀释CH3COOH、HClO两种酸时,溶液的pH随加水量变化的曲线如图所示,下列说法正确的是( )
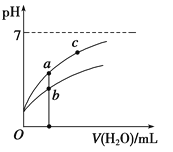
A.相同浓度的CH3COOH和HClO的混合溶液中,各离子浓度的大小关系是:
c(H+)>c(ClO-)>c(CH3COO-)>c(OH-)
B.图像中a、c两点所处的溶液中![]() 相等(HR代表CH3COOH或HClO)
相等(HR代表CH3COOH或HClO)
C.图像中a点酸的浓度大于b点酸的浓度
D.向NaClO溶液中通入少量二氧化碳的离子方程式为:2ClO-+CO2+H2O=2HClO+CO32—