题目内容
在密闭容器中进行反应:A(g)+3B(g) 2C(g),有关下列图像说法的不正确的是
2C(g),有关下列图像说法的不正确的是
| A.依据图a可判断正反应为放热反应 |
| B.在图b中,虚线可表示使用了催化剂 |
| C.若正反应的△H<0,图c可表示升高温度使平衡向逆反应方向移动 |
| D.由图d中混合气体的平均相对分子质量随温度的变化情况,可推知正反应的△H>0 |
D
解析试题分析:A、交点处v正=v逆,随着温度增大v正<v逆,平衡逆向移动,可判断正反应为放热反应,正确;B、使用催化剂不改变反应限度,但缩短到达平衡的时间,正确;C、若正反应的△H<0,升高温度v正、v逆都增大,但v正<v逆,正确;D、混合气体的平均相对分子质量=m总/n总,根据质量守恒m总是不变的,结合图像T升高,- M减小不能杀菌消毒,错误。
考点:化学平衡及移动规律。

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
一定条件下,C0与H2反应可生成乙醇:2CO+4H2? CH3CH20H+H20。下列关于该反应的说法错误的是
| A.增大CO的浓度能减小反应速率 |
| B.升高体系温度能增大反应速率 |
| C.使用合适的催化剂可增大反应速率 |
| D.若反应在密闭容器中进行,H2和C0不能全部转化为产物 |
己知反应A(s)+B(g) C(g)+D(g)的化学平衡常数和温度的关系如下:
C(g)+D(g)的化学平衡常数和温度的关系如下:
| 温度(℃) | 700 | 800 | 830 | 1000 | 1200 |
| 化学平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
下列说法正确的是
A.该反应的化学平衡常数表达式为:
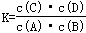
B.该反应为吸热反应
C.单位时间内生成B和D的物质的量相等时,该反应处于平衡状态
D.其它条件不变时,增大体系的压强,化学平衡常数减小
工业上采用乙烯和水蒸气合成乙醇的原理为:CH2=CH2(g) + H2O(g)  CH3CH2OH(g)。下图是乙烯的转化率随温度、压强的变化关系,下列说法正确的是( )
CH3CH2OH(g)。下图是乙烯的转化率随温度、压强的变化关系,下列说法正确的是( )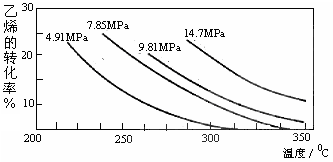
| A.该反应为吸热反应 |
| B.工业上采用7MPa左右,250~300℃,是综合考虑反应速率和乙醇的产率等因素的结果 |
| C.相同温度下,压强越大,乙烯的转化率越大,平衡常数越大 |
| D.给予足够的压强和适当的温度,可实现乙烯的转化率为 100% |
用CO合成甲醇(CH3OH)的化学反应方程式为CO(g)+2H2(g) CH3OH(g) △H<0;按照相同的物质的量投料,测的CO在不同温度下的平衡转化率与压强的关系如右图所示。下列说法正确的是
CH3OH(g) △H<0;按照相同的物质的量投料,测的CO在不同温度下的平衡转化率与压强的关系如右图所示。下列说法正确的是
| A.平衡常数:K(a)>K(c) K(b)=K(d) |
| B.正反应速率:v(a)>v(c) v(b)>v(d) |
| C.平均摩尔质量:M(a)<M(c) M(b)>M(d) |
| D.平衡时a点一定有n(CO):n(H2)=1:2 |
在密闭容器中进行反应:2A(g)+B(g) 3C(g)+Q(Q>0)。下列各图表示当其他条件不变时,改变某一条件对上述反应的影响,其中分析正确的是
3C(g)+Q(Q>0)。下列各图表示当其他条件不变时,改变某一条件对上述反应的影响,其中分析正确的是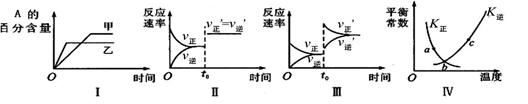
| A.图I表示温度对化学平衡的影响,且甲的温度较高 |
| B.图Ⅱ表示t0时刻缩小容器体积对反应速率的影响 |
| C.图Ⅲ表示t0时刻增大B浓度对反应速率的影响 |
| D.图Ⅳ中a、b、c三点中只有b点已经达到化学平衡状态 |
在一定温度下,饱和氯水中存在平衡:Cl2+H2O H++Cl-+HClO。下列说法中确的是
H++Cl-+HClO。下列说法中确的是
A.光照一段时间后,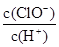 增大 增大 |
| B.加入碳酸钙粉末后,溶液的pH增大 |
| C.加入少量水,由水电离的c(H+)减小 |
| D.加入NaOH固体,一定有c(Na+)>c(Cl-)>c(H+)>c(ClO-)) |
把CoCl2溶解于浓盐酸中,溶液中存在下列平衡:
Co2+ + 4Cl— CoCl4— △H>0
CoCl4— △H>0
粉红色 蓝色
有关上述可逆反应的下列说法不正确的是 ( )
| A.对溶液所在体系加热,溶液蓝色加深 |
| B.对溶液所在体系用冰水降温,上述反应的平衡常数减小 |
| C.室温下,加水稀释,上述反应的平衡常数减小 |
| D.室温下,加水稀释至一定范围,溶液为粉红色 |
