题目内容
己知反应A(s)+B(g) C(g)+D(g)的化学平衡常数和温度的关系如下:
C(g)+D(g)的化学平衡常数和温度的关系如下:
| 温度(℃) | 700 | 800 | 830 | 1000 | 1200 |
| 化学平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
下列说法正确的是
A.该反应的化学平衡常数表达式为:
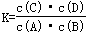
B.该反应为吸热反应
C.单位时间内生成B和D的物质的量相等时,该反应处于平衡状态
D.其它条件不变时,增大体系的压强,化学平衡常数减小
C
解析试题分析:A、A为固体,表达式错误;B、温度升高,K减小,平衡逆向移动,故逆反应为吸热,正反应放热,错误;C、生成B为逆方向,生成D为正方向,正确;D、增大压强,平衡逆向移动,化学平衡常数不变,错误。
考点:考查化学反应速率与化学平衡相关知识,涉及平衡常数表达式,平衡移动、平衡状态的判断等相关知识。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列反应达到平衡后,升高温度可以使混合气体平均相对分子质量增大的是( )
A.H2(g)+I2(g)  2HI(g) ΔH<0 2HI(g) ΔH<0 |
B.4NH3(g)+5O2(g) 4NO(g)+6H2O(g) ΔH<0 4NO(g)+6H2O(g) ΔH<0 |
C.N2(g)+3H2(g)  2NH3(g)ΔH<0 2NH3(g)ΔH<0 |
D.2SO3(g) 2SO2(g)+O2(g) ΔH>0 2SO2(g)+O2(g) ΔH>0 |
合成氨所需的氢气可用煤和水作原料经多步反应制得,其中的一步反应为:
CO(g)+ H2O(g) CO2(g) + H2(g) △H <0
CO2(g) + H2(g) △H <0
反应达到平衡后,为提高CO的转化率,下列措施中正确的是
| A.增加压强 | B.降低温度 | C.增大CO 的浓度 | D.更换催化剂 |
一定温度下,在4个容积均为1 L的恒容容器中分别进行反应(各容器中A都足量)
A(s)+B(g)  C(g)+D(g) ΔH ="+100" kJ·mol-1,某时刻测得部分数据如下表:
C(g)+D(g) ΔH ="+100" kJ·mol-1,某时刻测得部分数据如下表:
| 容器编号 | n(B)/mol | n(C)/mol | n(D)/mol | 反应时间/min | 反应速率 |
| Ⅰ | 0.06 | 0.60 | 0.10 | t1 | v(正)=v(逆) |
| Ⅱ | 0.12 | 1.20 | 0.20 | t2 | |
| Ⅲ | 0.32 | 1.0 | 0 | 0 | |
| Ⅳ | 0.12 | 0.30 | | | v(正)=v(逆) |
下列说法正确的是 ( )
A.容器Ⅰ中平均反应速率v(B)=0.04/t1 mol·L-1·min-1
B.t2时容器Ⅱ中v(正)>v(逆)
C.容器Ⅲ中反应至平衡时吸热20 kJ
D.容器Ⅳ中c(D)=" 0.4" mol·L-1
在一定温度下,容器内某一反应中M、N两种气体的物质的量随反应时间变化的曲线如图,下列表述中正确的( )
A.反应的化学方程式为:2M N N |
| B.t2时,正逆反应速率相等,达到平衡 |
| C.t3时,正反应速率大于逆反应速率 |
| D.t1时,N的浓度是M浓度的2倍 |
对于反应N2(g)+3H2(g) 2NH3(g) △H=-92kJ/mol,若只改变下列一个条件,一定能增大正反应速率且使平衡向正反应方向移动的是( )
2NH3(g) △H=-92kJ/mol,若只改变下列一个条件,一定能增大正反应速率且使平衡向正反应方向移动的是( )
| A.升高温度 | B.增大容器体积 |
| C.降低c(NH3) | D.将三种物质浓度均增大到原来的2倍 |
在密闭容器中进行反应:A(g)+3B(g) 2C(g),有关下列图像说法的不正确的是
2C(g),有关下列图像说法的不正确的是
| A.依据图a可判断正反应为放热反应 |
| B.在图b中,虚线可表示使用了催化剂 |
| C.若正反应的△H<0,图c可表示升高温度使平衡向逆反应方向移动 |
| D.由图d中混合气体的平均相对分子质量随温度的变化情况,可推知正反应的△H>0 |
N2(g)+3H2(g) 2NH3(g) △H=-92.4 kJ·mol-1。恒容时,体系中各物质浓度随时间变化的曲线如图示。下列说法错误的是
2NH3(g) △H=-92.4 kJ·mol-1。恒容时,体系中各物质浓度随时间变化的曲线如图示。下列说法错误的是
| A.前20分钟反应内放出的热量为46.2kJ |
| B.第25分钟改变的条件是将NH3从反应体系中分离出去 |
| C.若第60分钟时反应又达到了平衡,则时段Ⅲ改变的条件是降低温度 |
| D.时段Ⅰ仅将初始投放的物质浓度增至原来的2倍,则反应物的转化率增大,平衡常数不变 |
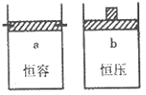
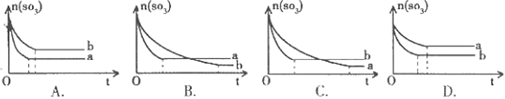
 2SO2(g)+O2(g),两容器中三氧化硫物质的量随时间(t)变化的示意图为
2SO2(g)+O2(g),两容器中三氧化硫物质的量随时间(t)变化的示意图为