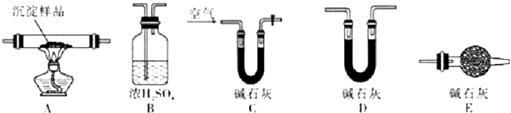
题目内容
20.某化学小组通过查阅资料,设计了如图所示的方法以含镍废催化剂为原料来制备NiSO4.已知某化工厂的含镍废催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%).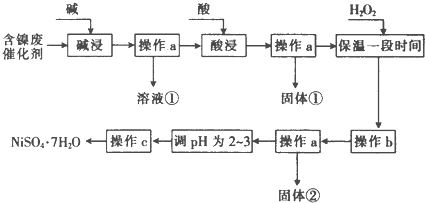
部分阳离子以氢氧化物形式沉淀时的pH如下:
| 沉淀物 | 开始沉淀时的pH | 完全沉淀时的pH |
| Al(OH)3 | 3.8 | 5.2 |
| Fe(OH)3 | 2.7 | 3.2 |
| Fe(OH)2 | 7.6 | 9.7 |
| Ni(OH)2 | 7.1 | 9.2 |
(2)“酸浸”时所加入的酸是H2SO4(填化学式).
(3)加入H2O2时发生反应的离子方程式为H2O2+2Fe2++2H+=2Fe3++2H2O
(4)操作b为调节溶液的pH,你认为pH的调控范围是3.2-7.1
(5)操作c为蒸发浓缩、冷却结晶过滤洗涤干燥等.
(6)产品晶体中有时会混有少量绿矾(FeS04•7H20),其原因可能是H2O2的用量不足(或H2O2失效)、保温时间不足导致Fe2+未被完全氧化造成的(写出一点即可).
(7)NiS04•7H20可用于制备镍氢电池(NiMH),镍氢电池目前已经成为混合动力汽车的一种主要电池类型.NiMH中的M表示储氢金属或合金.该电池在充电过程中总反应的化学方程式是Ni(OH)2+M=NiOOH+MH,则NiMH电池放电过程中,正极的电极反应式为NiOOH+H2O+e-=Ni(OH)2+OH-.
分析 由流程可知,某化工厂的含镍催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%).碱浸过滤得到固体加入酸浸过滤加入过氧化氢氧化亚铁离子为铁离子,调节溶液PH使铁离子和铝离子全部沉淀,镍离子不沉淀,过滤后调节溶液PH2-3防止镍离子水解,通过蒸发浓缩,冷却结晶,过滤洗涤得到NiSO4•7H2O晶体,
(1)含镍催化剂主要含有Ni,还含有Al(31%)的单质及氧化物,铝和氧化铝都可以和强碱反应溶解得到溶液含有偏铝酸盐;
(2)依据最后制备NiSO4•7H2O,防止引入其他杂志离子需要加入硫酸进行溶解;铁及其化合物、镍和硫酸反应生成亚铁离子、铁离子和镍离子;
(3)加入过氧化氢氧化亚铁离子为铁离子,铁离子易转化为沉淀除去;
(4)依据氢氧化物沉淀的PH分析判断,加入过氧化氢氧化亚铁离子为铁离子后,调节溶液pH使铁离子全部沉淀,镍离子不沉淀得到较纯净的硫酸镍溶液;
(5)溶液中得到溶质晶体的方法是蒸发浓缩,冷却结晶,过滤洗涤得到;
(6)含有绿矾晶体说明在加入过氧化氢保温过程中,过氧化氢未把亚铁离子全部氧化.
(7)正极上NiOOH得电子生成Ni(OH)2;
解答 解:由流程可知,某化工厂的含镍催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%).碱浸过滤得到固体加入酸浸过滤加入过氧化氢氧化亚铁离子为铁离子,调节溶液PH使铁离子和铝离子全部沉淀,镍离子不沉淀,过滤后调节溶液PH2-3防止镍离子水解,通过蒸发浓缩,冷却结晶,过滤洗涤得到NiSO4•7H2O晶体,
(1)“碱浸”过程中是为了除去铝及其氧化物,铝是两性元素和强碱反应,氧化铝是两性氧化物和强碱反应,镍单质和铁及其氧化物不和碱反应达到除去铝元素的目的;反应的两种方程式为:2Al+2OH-+2H2O═2AlO2-+3H2↑、Al2O3+2OH-═2AlO2-+3H2O,
故答案为:2Al+2OH-+2H2O═2AlO2-+3H2↑、Al2O3+2OH-═2AlO2-+H2O;
(2))“酸浸”时主要是溶解镍金属和铁单质及其氧化物,依据制备目的是得到NiSO4•7H2O,加入的酸不能引入新的杂质,所以需要加入硫酸进行酸浸;镍、铁和稀硫酸反应生成硫酸亚铁、硫酸镍溶液,则酸浸后,经操作a分离出固体①后,溶液中可能含有的金属离子是Ni2+、Fe2+、Fe3+;
故答案为:H2SO4;
(3)铁离子易转化为沉淀除去,加入过氧化氢氧化亚铁离子为铁离子,其反应的离子方程式为:H2O2+2Fe2++2H+=2Fe3++2H2O;
故答案为:H2O2+2Fe2++2H+=2Fe3++2H2O;
(4)依据图表中沉淀需要的溶液pH,加入过氧化氢氧化亚铁离子为铁离子后,调节溶液pH使铁离子全部沉淀,镍离子不沉淀得到较纯净的硫酸镍溶液,pH应在3.2-7.1间,
故答案为:3.2-7.1;
(5)溶液中得到溶质晶体的方法是蒸发浓缩,冷却结晶,过滤洗涤,操作c为蒸发浓缩,冷却结晶,
故答案为:蒸发浓缩,冷却结晶;
(6)产品晶体中有时会混有少量绿矾(FeSO4•7H2O),说明在加入过氧化氢氧化剂氧化亚铁离子时未把亚铁离子全部氧化,氢氧化亚铁沉淀的pH大于镍离子沉淀的pH,保温目的是把亚铁离子完全氧化,
故答案为:H2O2的用量不足(或H2O2失效)、保温时间不足导致Fe2+未被完全氧化造成的;
(7)NiMH电池放电过程中,正极上NiOOH得电子生成Ni(OH)2,则正极的电极方程式为:NiOOH+H2O+e-=Ni(OH)2+OH-,
故答案为:NiOOH+H2O+e-=Ni(OH)2+OH-;
点评 本题考查了物质分离的实验设计和方法应用、溶度积常数的有关计算,主要是利用溶液不同PH条件下离子沉淀的情况不同,控制溶液PH除去杂质离子,得到较纯净的硫酸镍溶液来制备硫酸镍晶体,同时考查了除杂原则不能引入新的杂质,铝及其化合物性质分析判断,题目难度中等.

| A. | 乙烯和苯都能使高锰酸钾溶液褪色 | |
| B. | 乙酸和油脂都能与氢氧化钠溶液反应 | |
| C. | 糖类和蛋白质都是人体重要的营养物质 | |
| D. | 乙烯和甲烷可用溴水鉴别 |
| A. | 1.0L 0.1mol/L的NH4Cl溶液中NH4+的个数为0.1NA | |
| B. | 常温下,Cu-Zn原电池中,正极产生1.12LH2时,转移的电子数为0.1NA | |
| C. | 常温下,0.05mol CO2和SO2混合气体中所含氧原子数为0.1NA | |
| D. | 高温高压下,1.4 g N2与0.3 g H2反应,生成的NH3分子数为0.1NA |
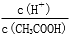 的比值将____________(填“增大”、“减小”或“无法确定”)。
的比值将____________(填“增大”、“减小”或“无法确定”)。 CO2(g)+H2(g)获取。
CO2(g)+H2(g)获取。 mol CO,反应达平衡后,测得CO的浓度为0.08 mol·L-1,则平衡时CO的转化率为 。
mol CO,反应达平衡后,测得CO的浓度为0.08 mol·L-1,则平衡时CO的转化率为 。 位时间内生成amolCO2的同时消耗amolH2
位时间内生成amolCO2的同时消耗amolH2 人员重视。它在安全性、价格等方面较化石燃料和氢燃料有着较大的优势。氨在燃烧实验中相关的反应有:
人员重视。它在安全性、价格等方面较化石燃料和氢燃料有着较大的优势。氨在燃烧实验中相关的反应有:

 ,
,