题目内容
5.某研究性学习小组将一定浓度的Na2CO3溶液滴入CuSO4溶液中得到蓝色沉淀.甲同学认为沉淀可能是CuSO3;乙同学认为沉淀可能是Cu(OH)2;丙同学认为沉淀可能是CuCO3,和Cu(OH)2的混合物.[查阅资料知:CuSO3和Cu(OH)2均不带结晶水,受热均易分解,各生成对应的两种氧化物.Ⅰ.(1)乙同学的观点,你认为其原理是:CO32-+Cu2++H2O=Cu(OH)2↓+CO2↑
.(用离子方程式表示)
(2)在探究沉淀成分前,须将沉淀从溶液中过滤、洗涤、低温干燥,检验沉淀是否洗涤干净的方法是取最后一次洗涤液,滴加BaCl2溶液,无沉淀生成,说明已洗净.
Ⅱ.请用图16所示装置,选择必要的试剂,定性探究生成物的成分.
(3)B装置中试剂的化学式是CuSO4.
(4)能证明生成物中有CuCO3的实验现象是装置C中澄清石灰水变浑浊.
Ⅲ.若丙同学的观点正确,可利用图所示装置通过实验定量测定其组成.
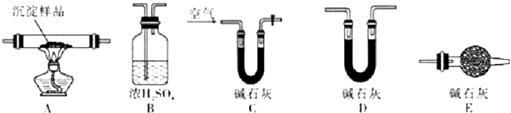
(5)各装置的连接顺序:C、A、B、D、E(或C、A、B、E、D).
(6)装置C中碱石灰的作用是吸收空气中的H2O蒸汽和CO2;,实验开始和结束时都要通入过量的空气,请说明结束时通入过量空气的作用是将装置中滞留的H2O蒸汽和CO2排出.
(7)若沉淀样品的质量为m克,装置B质量增加了n克,则沉淀中CuCO3的质量分数为1-$\frac{49n}{9m}$.
分析 Ⅰ.(1)CO32-水解成碱性,Cu2+与OH?结合生成Cu(OH)2;
(2)沉淀会附着SO42-离子,取最后一次洗涤液,用BaCl2溶液检验是否含有SO42-;
Ⅱ.(3)利用加热的方法检验,氢氧化铜和碳酸铜加热分解得到氧化铜、水和二氧化碳,若有氢氧化铜可用无水硫酸铜检验;
(4)碳酸铜可用澄清的石灰水检验产生的二氧化碳,澄清石灰水变浑浊说明含有CuCO3;
Ⅲ.(5)根据CuCO3和Cu(OH)2受热分解的产物和检验所产生的现象来连接装置;
(6)碱石灰可以吸收水和二氧化碳,空气中的水以及二氧化碳会干扰试验结果应该将其排除掉;
(7)装置B质量增加了n克,即生成水的质量是ng,根据原子守恒来回答.
解答 解:Ⅰ.(1)乙同学认为沉淀可能是Cu(OH)2,原因是CO32-水解成碱性,Cu2+与OH?结合生成Cu(OH)2,反应的离子方程式为:CO32-+Cu2++H2O=Cu(OH)2↓+CO2↑,
故答案为:CO32-+Cu2++H2O=Cu(OH)2↓+CO2↑;
(2)沉淀会附着SO42-离子,则检验沉淀是否洗涤干净的方法是:取最后一次洗涤液,滴加BaCl2溶液,无沉淀生成,说明已洗净,
故答案为:取最后一次洗涤液,滴加BaCl2溶液,无沉淀生成,说明已洗净;
Ⅱ.(3)装置B检验是否有水生成,可用无水硫酸铜检验,若无水硫酸铜变蓝色说明有水生成,验证沉淀中有氢氧化铜生成,否则沉淀中无氢氧化铜,
故答案为:CuSO4;
(4)用澄清的石灰水检验是否产生二氧化碳,装置C中澄清石灰水变浑浊,说明生成二氧化碳,即说明含有CuCO3,
故答案为:装置C中澄清石灰水变浑浊;
Ⅲ.(5)碱石灰可以吸收水和二氧化碳,空气中的水以及二氧化碳会干扰试验结果应该将其在实验之前排除掉,并在装置的最后放上碱石灰,防止空气中的水和二氧化碳来干扰试验结果,可以用浓硫酸来吸收水,用碱石灰来吸收二氧化碳,根据浓硫酸和碱石灰的增重量来确定生成水和二氧化碳的量,
故答案为:C、A、B、D、E (或C、A、B、E、D);
(6)装置C中碱石灰的作用是:吸收空气中的H2O 蒸汽和CO2,验开始时和实验结束时都要通入过量且处理过的空气其作用都是将装置中滞留的H2O 蒸汽和CO2排出,
故答案为:吸收空气中的H2O 蒸汽和CO2; 将装置中滞留的H2O 蒸汽和CO2排出;
(7)装置B质量增加了n克,即生成水的质量是ng,根据方程式则生成的氢氧化铜的物质的质量是:$\frac{98n}{18}$g=$\frac{49n}{9}$g,所以碳酸铜的质量是(m-$\frac{49n}{9}$)g,质量分数为:$\frac{mg-\frac{49n}{9}g}{mg}$=1-$\frac{49n}{9m}$,
故答案为:1-$\frac{49n}{9m}$.
点评 本题考查实验方案设计与装置的理解评价、物质组成与含量的测定、实验基本操作,难度中等,理解实验原理是解题的关键,是对知识的综合运用,需要学生具备扎实的基础知识与运用知识分析问题、解决问题的能力.

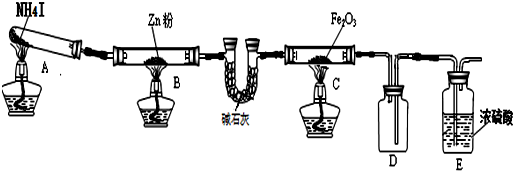
完成下列填空:
(1)实验时A中有大量紫红色的烟气,烟气的主要成份是NH3、H2、I2、HI,在上图装置中,碱石灰的作用是吸收混合气体中的HI;
(2)装置B中,Zn会与I2发生反应,其反应化学方程式Zn+I2═ZnI2
-;
(3)按上图装置进行对比实验,甲组用酒精灯、乙组用酒精喷灯对装置C加热,反应产物均为黑色粉末 (纯净物),两组分别用各自的产物进行以下探究,完成下列填空:
| 步骤 | 操作 | 甲组现象 | 乙组现象 |
| 1 | 取黑色粉末加入稀盐酸 | 溶解,无气泡 | 溶解,有气泡 |
| 2 | 取步骤1中溶液,滴加KSCN溶液 | 变红 | 无明显变化 |
| 3 | 向步骤2溶液中滴加新制氯水 | 红色先变深后褪去 | 先变红后也褪色 |
(4)若装置C中反应后的固体是Fe2O3和FeO组成的混合物.为确定其组成,取样品7.84克,在加热 条件下通入足量的氨气,完全反应后,停止加热,Fe2O3和FeO都被还原为Fe,反应管中铁粉冷却后,称得质量为5.6克,则混合物中Fe2O3和FeO的物质的量之比为2:1.
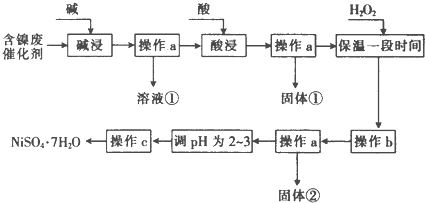
部分阳离子以氢氧化物形式沉淀时的pH如下:
| 沉淀物 | 开始沉淀时的pH | 完全沉淀时的pH |
| Al(OH)3 | 3.8 | 5.2 |
| Fe(OH)3 | 2.7 | 3.2 |
| Fe(OH)2 | 7.6 | 9.7 |
| Ni(OH)2 | 7.1 | 9.2 |
(2)“酸浸”时所加入的酸是H2SO4(填化学式).
(3)加入H2O2时发生反应的离子方程式为H2O2+2Fe2++2H+=2Fe3++2H2O
(4)操作b为调节溶液的pH,你认为pH的调控范围是3.2-7.1
(5)操作c为蒸发浓缩、冷却结晶过滤洗涤干燥等.
(6)产品晶体中有时会混有少量绿矾(FeS04•7H20),其原因可能是H2O2的用量不足(或H2O2失效)、保温时间不足导致Fe2+未被完全氧化造成的(写出一点即可).
(7)NiS04•7H20可用于制备镍氢电池(NiMH),镍氢电池目前已经成为混合动力汽车的一种主要电池类型.NiMH中的M表示储氢金属或合金.该电池在充电过程中总反应的化学方程式是Ni(OH)2+M=NiOOH+MH,则NiMH电池放电过程中,正极的电极反应式为NiOOH+H2O+e-=Ni(OH)2+OH-.
| A. | 仅含有碳和氢两种元素的化合物称为烃 | |
| B. | 凡是分子里含碳元素的化合物都属于烃 | |
| C. | 甲烷可以使酸性高锰酸钾溶液褪色 | |
| D. | 有机化合物分子中碳原子之间只有单键 |
| A. | 淀粉和纤维素的相对分子质量相同,互称同分异构体 | |
| B. | 糖类、油脂、蛋白质都属于天然高分子化合物 | |
| C. | 油脂在酸性条件下和碱性条件下都可以水解,且水解产物均相同 | |
| D. | 在允许加热的条件下,可以用氢氧化铜鉴别葡萄糖、乙酸、乙醇 |
| A. | Na3PO4 | B. | A12(SO4)3 | C. | BaCl2 | D. | K2SO4 |
| A. | 用结晶的方法分离汽油和水 | |
| B. | 用过滤的方法除去氯化钠溶液中的泥沙 | |
| C. | 用重结晶的方法从含有少量氯化钠的硝酸钾溶液中提取硝酸钾 | |
| D. | 蒸馏法分离乙酸(沸点118.)和乙酸乙酯(沸点77.1.) |
 V2=50ml)。下列叙述正确的是( )
V2=50ml)。下列叙述正确的是( )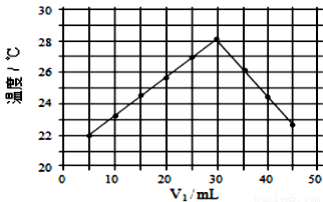
 O2(g)===CO2(g);ΔH=-282.8 kJ·mol-1
O2(g)===CO2(g);ΔH=-282.8 kJ·mol-1