题目内容
7.设阿伏加德罗常数的值为NA.下列叙述正确的是( )| A. | 1.0L 0.1mol/L的NH4Cl溶液中NH4+的个数为0.1NA | |
| B. | 常温下,Cu-Zn原电池中,正极产生1.12LH2时,转移的电子数为0.1NA | |
| C. | 常温下,0.05mol CO2和SO2混合气体中所含氧原子数为0.1NA | |
| D. | 高温高压下,1.4 g N2与0.3 g H2反应,生成的NH3分子数为0.1NA |
分析 A、NH4+是弱碱阳离子,在溶液中会水解;
B、氢气所处的状态不是标况,不能根据气体摩尔体积为22.4L/mol来计算;
C、CO2和SO2中均含2个氧原子;
D、合成氨的反应为可逆反应,进行不彻底.
解答 解:A、NH4+是弱碱阳离子,在溶液中会水解,故溶液中的铵根离子的个数小于0.1NA个,故A错误;
B、氢气所处的状态不是标况,不能根据气体摩尔体积为22.4L/mol来计算,故其物质的量不是0.05mol,则转移的电子数不是0.1NA个,故B错误;
C、CO2和SO2中均含2个氧原子,故0.05mol混合气体中含有的氧原子的物质的量为0.1mol即0.1NA个,与混合气体中两者的比例无关,故C正确;
D、1.4g氮气的物质的量n=$\frac{1.4g}{28g/mol}$=0.05mol,0.3g氢气的物质的量为0.15mol,但氨气合成氨的反应为可逆反应,进行不彻底,故生成的氨气分子的个数小于0.1NA个,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的计算,掌握公式的运用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
20.某化学小组通过查阅资料,设计了如图所示的方法以含镍废催化剂为原料来制备NiSO4.已知某化工厂的含镍废催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%).
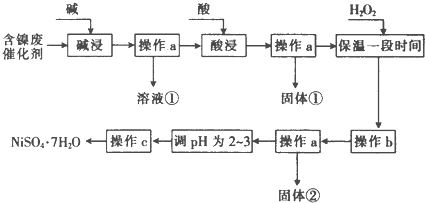
部分阳离子以氢氧化物形式沉淀时的pH如下:
(1)“碱浸”过程中发生反应的离子方程式是2Al+2OH-+2H2O═2AlO2-+3H2↑、Al2O3+2OH-═2AlO2-+H2O
(2)“酸浸”时所加入的酸是H2SO4(填化学式).
(3)加入H2O2时发生反应的离子方程式为H2O2+2Fe2++2H+=2Fe3++2H2O
(4)操作b为调节溶液的pH,你认为pH的调控范围是3.2-7.1
(5)操作c为蒸发浓缩、冷却结晶过滤洗涤干燥等.
(6)产品晶体中有时会混有少量绿矾(FeS04•7H20),其原因可能是H2O2的用量不足(或H2O2失效)、保温时间不足导致Fe2+未被完全氧化造成的(写出一点即可).
(7)NiS04•7H20可用于制备镍氢电池(NiMH),镍氢电池目前已经成为混合动力汽车的一种主要电池类型.NiMH中的M表示储氢金属或合金.该电池在充电过程中总反应的化学方程式是Ni(OH)2+M=NiOOH+MH,则NiMH电池放电过程中,正极的电极反应式为NiOOH+H2O+e-=Ni(OH)2+OH-.

部分阳离子以氢氧化物形式沉淀时的pH如下:
| 沉淀物 | 开始沉淀时的pH | 完全沉淀时的pH |
| Al(OH)3 | 3.8 | 5.2 |
| Fe(OH)3 | 2.7 | 3.2 |
| Fe(OH)2 | 7.6 | 9.7 |
| Ni(OH)2 | 7.1 | 9.2 |
(2)“酸浸”时所加入的酸是H2SO4(填化学式).
(3)加入H2O2时发生反应的离子方程式为H2O2+2Fe2++2H+=2Fe3++2H2O
(4)操作b为调节溶液的pH,你认为pH的调控范围是3.2-7.1
(5)操作c为蒸发浓缩、冷却结晶过滤洗涤干燥等.
(6)产品晶体中有时会混有少量绿矾(FeS04•7H20),其原因可能是H2O2的用量不足(或H2O2失效)、保温时间不足导致Fe2+未被完全氧化造成的(写出一点即可).
(7)NiS04•7H20可用于制备镍氢电池(NiMH),镍氢电池目前已经成为混合动力汽车的一种主要电池类型.NiMH中的M表示储氢金属或合金.该电池在充电过程中总反应的化学方程式是Ni(OH)2+M=NiOOH+MH,则NiMH电池放电过程中,正极的电极反应式为NiOOH+H2O+e-=Ni(OH)2+OH-.
1.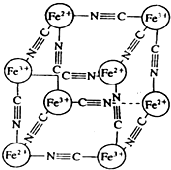 分析化学中常用X射线研究晶体结构,有一种蓝色晶体[可表示为:MxFey(CN)z],研究表明它的结构特性是:Fe2+和Fe3+分别占据立方体的顶点,自身互不相邻,而CN-位于立方体的棱上.其晶体中的阴离子晶胞结构如图示,下列说法不正确的是( )
分析化学中常用X射线研究晶体结构,有一种蓝色晶体[可表示为:MxFey(CN)z],研究表明它的结构特性是:Fe2+和Fe3+分别占据立方体的顶点,自身互不相邻,而CN-位于立方体的棱上.其晶体中的阴离子晶胞结构如图示,下列说法不正确的是( )
 分析化学中常用X射线研究晶体结构,有一种蓝色晶体[可表示为:MxFey(CN)z],研究表明它的结构特性是:Fe2+和Fe3+分别占据立方体的顶点,自身互不相邻,而CN-位于立方体的棱上.其晶体中的阴离子晶胞结构如图示,下列说法不正确的是( )
分析化学中常用X射线研究晶体结构,有一种蓝色晶体[可表示为:MxFey(CN)z],研究表明它的结构特性是:Fe2+和Fe3+分别占据立方体的顶点,自身互不相邻,而CN-位于立方体的棱上.其晶体中的阴离子晶胞结构如图示,下列说法不正确的是( )| A. | 该晶体是离子晶体 | |
| B. | M的离子位于上述晶胞面心,呈+2价 | |
| C. | 晶体的化学式可表示为MFe2(CN)6,且M为+1价 | |
| D. | M的离子位于上述晶胞体心,呈+2价 |
15.在CH3COOH+C2H5OH$?_{△}^{浓硫酸}$CH3COOC2H5+H2O的平衡体系中,加入一定量的C2H518OH,当重新达到平衡时,18O原子应存在于( )
| A. | 乙酸乙酯中 | B. | 乙酸中 | ||
| C. | 水中 | D. | 乙酸、乙酸乙酯和水中 |
2.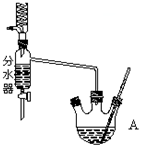 实验室用乙酸和正丁醇制备乙酸正丁酯.有关物质的相关数据如下表:
实验室用乙酸和正丁醇制备乙酸正丁酯.有关物质的相关数据如下表:
操作如下:
①在50mL三颈烧瓶中投入几粒沸石,将18.5mL正丁醇和13.4mL冰醋酸(过量),3~4滴浓硫酸按一定顺序均匀混合,安装分水器(作用:实验过程中不断分离除去反应生成的水)、温度计及回流冷凝管.
②将分水器分出的酯层和反应液一起倒入分液漏斗中依次用水洗,10% Na2CO3洗,再水洗,最后转移至锥形瓶并干燥.
③将干燥后的乙酸正丁酯加入烧瓶中,常压蒸馏,收集馏分,得15.1g乙酸正丁酯.
请回答有关问题:
(1)写出任意一种正丁醇同类的同分异构体的结构简式CH3CH2CH(OH)CH3.
(2)仪器A中发生反应的化学方程式为CH3COOH+CH3CH2CH2CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH2CH2CH3+H2O.
(3)步骤 ①向三颈烧瓶中依次加入的药品是:正丁醇,浓硫酸,冰醋酸.
(4)步骤 ②中,用 10%Na2CO3溶液洗涤有机层,该步操作的目的是除去酯中混有的乙酸和正丁醇.
(5)步骤 ③在进行蒸馏操作时,若从118℃开始收集馏分,产率偏高,(填“高”或“低”)原因是会收集到少量未反应的冰醋酸和正丁醇
(6)该实验生成的乙酸正丁酯的产率是65%.
 实验室用乙酸和正丁醇制备乙酸正丁酯.有关物质的相关数据如下表:
实验室用乙酸和正丁醇制备乙酸正丁酯.有关物质的相关数据如下表:| 化合物 | 相对分子质量 | 密度/g•cm-3 | 沸点/℃ | 溶解度g/l00g水 |
| 正丁醇 | 74 | 0.80 | 118.0 | 9 |
| 冰醋酸 | 60 | 1.045 | 118.1 | 互溶 |
| 乙酸正丁酯 | 116 | 0.882 | 126.1 | 0.7 |
①在50mL三颈烧瓶中投入几粒沸石,将18.5mL正丁醇和13.4mL冰醋酸(过量),3~4滴浓硫酸按一定顺序均匀混合,安装分水器(作用:实验过程中不断分离除去反应生成的水)、温度计及回流冷凝管.
②将分水器分出的酯层和反应液一起倒入分液漏斗中依次用水洗,10% Na2CO3洗,再水洗,最后转移至锥形瓶并干燥.
③将干燥后的乙酸正丁酯加入烧瓶中,常压蒸馏,收集馏分,得15.1g乙酸正丁酯.
请回答有关问题:
(1)写出任意一种正丁醇同类的同分异构体的结构简式CH3CH2CH(OH)CH3.
(2)仪器A中发生反应的化学方程式为CH3COOH+CH3CH2CH2CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH2CH2CH3+H2O.
(3)步骤 ①向三颈烧瓶中依次加入的药品是:正丁醇,浓硫酸,冰醋酸.
(4)步骤 ②中,用 10%Na2CO3溶液洗涤有机层,该步操作的目的是除去酯中混有的乙酸和正丁醇.
(5)步骤 ③在进行蒸馏操作时,若从118℃开始收集馏分,产率偏高,(填“高”或“低”)原因是会收集到少量未反应的冰醋酸和正丁醇
(6)该实验生成的乙酸正丁酯的产率是65%.
12.下列物质的分离方法不正确的是( )
| A. | 用结晶的方法分离汽油和水 | |
| B. | 用过滤的方法除去氯化钠溶液中的泥沙 | |
| C. | 用重结晶的方法从含有少量氯化钠的硝酸钾溶液中提取硝酸钾 | |
| D. | 蒸馏法分离乙酸(沸点118.)和乙酸乙酯(沸点77.1.) |
19.将乙醛和乙酸分离的正确方法是( )
| A. | 加热蒸馏 | |
| B. | 先加入烧碱溶液,之后蒸馏出乙醛;再加入浓硫酸,蒸馏出乙酸 | |
| C. | 加入Na2CO3后,通过萃取的方法分离 | |
| D. | 利用银镜反应进行分离 |
16.关于如图所示的原电池,下列说法正确的是( )
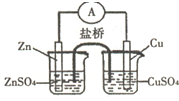

| A. | 电子从锌电极通过电流表流向铜电极 | |
| B. | 盐桥中的阴离子向硫酸铜溶液中迁移 | |
| C. | 取出盐桥后,电流计的指针仍发生偏转 | |
| D. | 铜电极上发生的电极反应是2H++2e-═H2↑ |
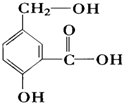 某有机物A的结构简式如图.
某有机物A的结构简式如图.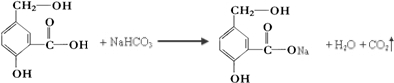 .
.