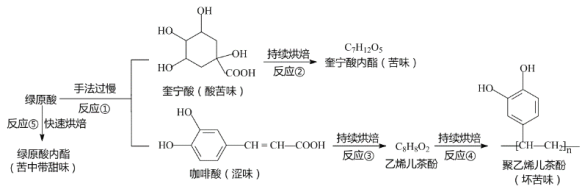
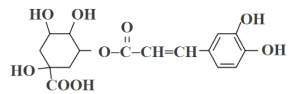题目内容
【题目】在![]() 时,FeS的
时,FeS的![]() ,CuS的
,CuS的![]() ,ZnS的
,ZnS的![]() 常温时下列有关说法中正确的是( )
常温时下列有关说法中正确的是( )
A.FeS的溶解度大于CuS的溶解度
B.饱和CuS溶液中![]() 的浓度为
的浓度为![]()
![]()
C.向物质的量浓度相同的![]() 、
、![]() 的混合液中加入少量
的混合液中加入少量![]() ,只有FeS沉淀生成
,只有FeS沉淀生成
D.向饱和ZnS溶液中加入少量![]() 固体,ZnS的
固体,ZnS的![]() 变大
变大
【答案】A
【解析】
本题主要考查沉淀溶解平衡。
A.同类型的难溶电解质Ksp越小,其溶解度越小;
B.结合Ksp计算;
C.Ksp小的先沉淀;
D.Ksp只与温度有关。
A. 由FeS的![]() 、CuS的
、CuS的![]() 可知,FeS的溶解度大于CuS的溶解度,故A正确;
可知,FeS的溶解度大于CuS的溶解度,故A正确;
B. 饱和CuS溶液中Cu2+的浓度为![]() ,故B错误;
,故B错误;
C. ZnS的![]() , FeS的
, FeS的![]() ,向物质的量浓度相同的FeCl2、ZnCl2的混合液中加入少量Na2S,只生成ZnS沉淀,故C错误;
,向物质的量浓度相同的FeCl2、ZnCl2的混合液中加入少量Na2S,只生成ZnS沉淀,故C错误;
D. 向饱和ZnS溶液中加入少量ZnCl2固体,平衡逆向移动,但温度不变,ZnS的Ksp不变,故D错误;
故选:A。

 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案【题目】毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl22H2O的流程如下:
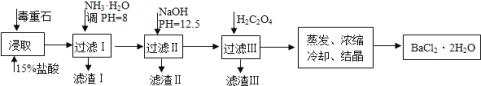
(1)写出“浸取”环节发生的主要离子方程式______。实验室用37%的盐酸配置15%的盐酸,除量筒外还需使用下列仪器中的______。(双选,填选项字母)
a.烧杯b.容量瓶c.滴定管d.玻璃棒
(2)下图是一些难溶氢氧化物在不同pH下的沉淀一溶解图
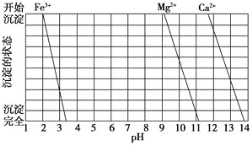
已知:Ksp(BaC2O4)= 1.6×10-7, Ksp(CaC2O4)= 2.3×10-9,
①滤渣I中含_____(填化学式)。再加入NaOH调节pH=12.5可除去______(填离子符号)
②加入H2C2O4应避免过量的原因是________
(3)25℃,H2C2O4的电离平衡常数如下:
H2C2O4 | Ka1=5.36×10-2 | Ka2=5.35×10-5 |
①HC2O4-的电离平衡常数表达式Ka2=__________
②NaHC2O4溶液呈_______(酸性、碱性、中性)