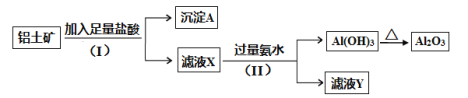
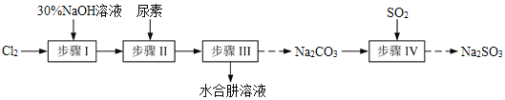
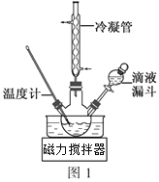
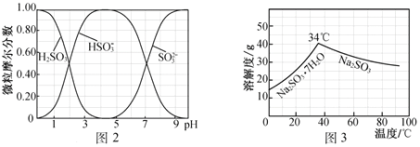
题目内容
【题目】由Na、Mg、A1、Fe四种金属单质中的两种组成的混合物共12g,跟足量盐酸反应,产生5.6LH2(标准状况下),由此可判断混合物中必定含有
A. Na B. Fe C. Mg D. Al
【答案】B
【解析】标准状况下5.6L氢气的物质的量是5.6L÷22.4L/mol=0.25mol,转移0.5mol电子。根据电子得失守恒可知消耗金属Na、Mg、A1、Fe四种金属单质的质量分别是11.5g、12g、4.5g、14g,由于混合物共计是12g,则混合物中必定含有铁,答案选B。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目