题目内容
4.用以下三种途径来制取相等质量的硝酸铜:(1)铜跟浓硝酸反应;(2)铜跟稀硝酸反应;(3)铜先跟氧气反应生成氧化铜,氧化铜再跟硝酸反应.以下叙述中正确的是( )| A. | 三种途径所消耗的铜的物质的量相等 | |
| B. | 三种途径所消耗的硝酸的物质的量相等 | |
| C. | 所消耗的铜的物质的量是:途径(3)>途径(1)>途径(2) | |
| D. | 所消耗的硝酸的物质的量是:途径(1)>途径(2)>途径(3) |
分析 制取硝酸铜有关反应为:①Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O;
②3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O;
③2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO,CuO+2HNO3(稀)=Cu(NO3)2+H2O
依据方程式判断生成相同质量的Cu(NO3)2,消耗原料的多少.
解答 解:制取硝酸铜有关反应为:①Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O;
②3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O;
③2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO,CuO+2HNO3(稀)=Cu(NO3)2+H2O
从以上三组反应可以看出:生成相同质量的Cu(NO3)2,消耗相同质量的铜;
消耗硝酸的质量(或物质的量)不相同,途径①消耗HNO3最多,途径②次之,途径③消耗HNO3最少.故选AD.
点评 本题考查硝酸铜的制备方案的评价,题目难度不大,注意要正确书写相关反应的化学方程式,题目可根据方程式进行判断.

练习册系列答案
相关题目
18.在某恒温恒容密闭容器中,发生反应:A(g)+B(g)?2C(g)△H=-Q kJ/mol(Q>0),保持其它条件不变,只改变起始添加量,测得相关数据如表所示
下列说法中错误的是( )
| 起始加入量(mol) | 平衡时 | ||||
| A | B | C | A或C转化率(%) | C的物质的量分数(%) | 放出或吸收热量(kJ) |
| 1 | 1 | 0 | α1 | φ1 | Q1 |
| 0 | 0 | 2 | α2 | φ2 | Q2 |
| 2 | 2 | 0 | α3 | φ3 | Q3 |
| A. | α1+α2=1; φ2=φ1 | B. | α1=α3;Q1+Q2=Q | ||
| C. | φ3=φ1=φ2; Q3=2Q1 | D. | φ3=2φ1; Q3=Q1 |
19.只给出表中甲和乙对应的量,不能用来求物质的量的是( )
| 甲 | 乙 | |
| A | 物质A的分子数 | 一个A分子的质量 |
| B | 标准状况下气体摩尔体积 | 标准状况下气体体积 |
| C | 固体体积 | 固体密度 |
| D | 非标准状况下物质的质量 | 物质的摩尔质量 |
| A. | A | B. | B | C. | C | D. | D |
16.现有下列试剂:①蒸馏水;②AgNO3溶液;③BaCl2溶液;④稀盐酸,欲检验硝酸钠固体中是否含有少量可溶性硫酸盐杂质,应选用的试剂是( )
| A. | ①③④ | B. | ②④ | C. | ③④ | D. | ①②③ |
3.苯燃烧热的热化学方程式为C6H6(l)+$\frac{15}{2}$O2(g)=6CO2(g)+3H2O(l)△H=-3260kJ•mol-1,设阿伏伽德罗常数的值为NA,下列说法正确的是( )
| A. | 断裂3NA个碳碳双键时,放出3260kJ的热量 | |
| B. | 消耗336L O2时,放出6520kJ的热量 | |
| C. | 转移30NA个电子时,放出3260kJ的热量 | |
| D. | 生成3NA个气态水分子时,放出3260kJ的热量 |
16. 溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
按下列合成步骤回答问题:
(1)写出实验室合成溴苯的化学反应方程式: +Br2$\stackrel{铁粉}{→}$
+Br2$\stackrel{铁粉}{→}$ +HBr.
+HBr.
(2)在a中加入15mL无水苯和少量铁屑.在b中小心加入4.0mL液态溴.由b向a中滴入几滴溴,有白雾产生,是因为生成了气体.继续滴加至液溴滴完.装置d的作用是吸收HBr和Br2.
(3)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10mL水,然后过滤除去未反应的铁屑;
②滤液依次用10mL水、8mL10%的NaOH溶液、10mL水洗涤.NaOH溶液洗涤的作用是除去HBr和未反应的Br2;
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤.加入氯化钙的目的是干燥.
(4)在该实验中,a的容积最适合的是B(填入正确选项前的字母).
A.25mL B.50mL C.250mL D.500mL.
 溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:| 苯 | 溴 | 溴苯 | |
| 密度/g•cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/℃ | 80 | 59 | 156 |
| 水中溶解度 | 微溶 | 微溶 | 微溶 |
(1)写出实验室合成溴苯的化学反应方程式:
 +Br2$\stackrel{铁粉}{→}$
+Br2$\stackrel{铁粉}{→}$ +HBr.
+HBr.(2)在a中加入15mL无水苯和少量铁屑.在b中小心加入4.0mL液态溴.由b向a中滴入几滴溴,有白雾产生,是因为生成了气体.继续滴加至液溴滴完.装置d的作用是吸收HBr和Br2.
(3)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10mL水,然后过滤除去未反应的铁屑;
②滤液依次用10mL水、8mL10%的NaOH溶液、10mL水洗涤.NaOH溶液洗涤的作用是除去HBr和未反应的Br2;
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤.加入氯化钙的目的是干燥.
(4)在该实验中,a的容积最适合的是B(填入正确选项前的字母).
A.25mL B.50mL C.250mL D.500mL.
14.在蒸发皿中用酒精灯加热蒸干下列物质的溶液然后灼烧,可以得到该物质固体的是( )
| A. | 氯化铁 | B. | 碳酸氢钠 | C. | 硫酸铝 | D. | 高锰酸钾 |
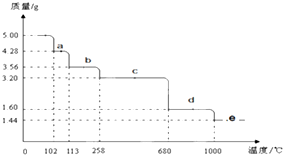 Cu2S是火法炼铜的重要原料之一,下面是由Cu2S冶炼铜及制取CuSO4•5H2O的流程图:
Cu2S是火法炼铜的重要原料之一,下面是由Cu2S冶炼铜及制取CuSO4•5H2O的流程图: