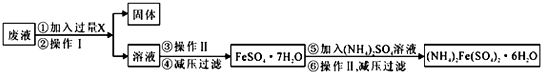
题目内容
16. 溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:| 苯 | 溴 | 溴苯 | |
| 密度/g•cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/℃ | 80 | 59 | 156 |
| 水中溶解度 | 微溶 | 微溶 | 微溶 |
(1)写出实验室合成溴苯的化学反应方程式:
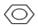 +Br2$\stackrel{铁粉}{→}$
+Br2$\stackrel{铁粉}{→}$ +HBr.
+HBr.(2)在a中加入15mL无水苯和少量铁屑.在b中小心加入4.0mL液态溴.由b向a中滴入几滴溴,有白雾产生,是因为生成了气体.继续滴加至液溴滴完.装置d的作用是吸收HBr和Br2.
(3)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10mL水,然后过滤除去未反应的铁屑;
②滤液依次用10mL水、8mL10%的NaOH溶液、10mL水洗涤.NaOH溶液洗涤的作用是除去HBr和未反应的Br2;
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤.加入氯化钙的目的是干燥.
(4)在该实验中,a的容积最适合的是B(填入正确选项前的字母).
A.25mL B.50mL C.250mL D.500mL.
分析 (1)实验室合成溴苯是苯与液溴在铁粉作催化剂的条件下发生取代反应生成溴苯和溴化氢;
(2)苯与液溴反应生成HBr,苯的卤代反应是放热反应,液溴易挥发,所以尾气中有HBr及挥发出的Br2,用氢氧化钠溶液吸收,防止污染大气;
(3)根据溴苯中含有溴,单质溴能与NaOH溶液反应生成NaBr和NaBrO溶于水中,而溴苯不与NaOH溶液反应,也不溶于水,分液后,然后加干燥剂,据此解答;
(4)根据制取溴苯所加的液体的体积以及溶液的体积一般不超容器的$\frac{2}{3}$,不少于$\frac{1}{3}$来解答;
解答 解:(1)实验室合成溴苯是苯与液溴在铁粉作催化剂的条件下发生取代反应生成溴苯和溴化氢,反应方程式为 +Br2$\stackrel{铁粉}{→}$
+Br2$\stackrel{铁粉}{→}$ +HBr,
+HBr,
故答案为: +Br2$\stackrel{铁粉}{→}$
+Br2$\stackrel{铁粉}{→}$ +HBr;
+HBr;
(2)苯与液溴反应生成HBr,苯的卤代反应是放热反应,液溴易挥发,所以尾气中有HBr及挥发出的Br2,用氢氧化钠溶液吸收,防止污染大气,所以装置d的作用是吸收HBr和Br2,
故答案为:吸收HBr和Br2;
(3)溴苯提纯的方法是:先水洗,把可溶物溶解在水中,然后过滤除去未反应的铁屑,再加NaOH溶液,把未反应的Br2变成NaBr和NaBrO洗到水中,然后加干燥剂,无水氯化钙能干燥溴苯,
故答案为:除去HBr和未反应的Br2;干燥;
(4)操作过程中,先在a中加入15mL无水苯,在b中小心加入4.0mL液态溴,最后向a中加入10mL水,共约30mL,所以a的容积最适合的是50mL,
故答案为:B.
点评 本题主要考查了溴苯的制取实验、物质的分离提纯等,清楚制备的原理是解答的关键,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
10.下列说法正确的是( )
| A. | 物质发生化学反应时不一定都伴随着能量变化 | |
| B. | 一个化学反应中,当反应物总能量大于反应产物总能量时,反应放热,△H>0 | |
| C. | 在加热条件下发生的反应均为吸热反应 | |
| D. | 同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H相同 |
11.VL K2SO4溶液中,含有K+mg,则溶液中SO42-的物质的量浓度为( )
| A. | $\frac{39m}{V}$mol•L-1 | B. | $\frac{2m}{39V}$mol•L-1 | C. | $\frac{m}{39V}$mol•L-1 | D. | $\frac{m}{78V}$mol•L-1 |
4.用以下三种途径来制取相等质量的硝酸铜:(1)铜跟浓硝酸反应;(2)铜跟稀硝酸反应;(3)铜先跟氧气反应生成氧化铜,氧化铜再跟硝酸反应.以下叙述中正确的是( )
| A. | 三种途径所消耗的铜的物质的量相等 | |
| B. | 三种途径所消耗的硝酸的物质的量相等 | |
| C. | 所消耗的铜的物质的量是:途径(3)>途径(1)>途径(2) | |
| D. | 所消耗的硝酸的物质的量是:途径(1)>途径(2)>途径(3) |
1. 正丁醚是惰性溶剂,可用作有机合成反应溶剂.某实验小组利用如下装置(夹持和加热装置均省略)合成正丁醚.发生的反应为:
正丁醚是惰性溶剂,可用作有机合成反应溶剂.某实验小组利用如下装置(夹持和加热装置均省略)合成正丁醚.发生的反应为:
2CH3CH2CH2CH2OH$\stackrel{H_{2}SO_{4}}{→}$CH3CH2CH2CH2OCH2CH2CH2CH3+H2O
反应物和产物的相关数据列表如下:
实验步骤:在一定容积的三口烧瓶中,加入10.9g(相当13.5mL)正丁醇、2.5mL浓硫酸和几粒沸石,摇匀后,一口装上温度计,温度计插入液面以下,另一口装上分水器,分水器的上端接球形冷凝管,先在分水器内放置1.7mL水,另一口用塞子塞紧.然后将三口瓶放在石棉网上小火加热至微沸,进行分水.反应中产生的水经球形冷凝管后,收集在分水器的下层,上层有机层积至分水器支管时,即可返回烧瓶.大约经1.5h后,三口瓶中反应液温度可达134一136℃,当下层水至分水器的支管口处停止反应.
将反应液冷却到室温后倒入盛有25mL水的分液漏斗中,经过分离、洗涤后再分离提纯可得正丁醚3.4g.回答下列问题:
(1)该实验时球形冷凝管的进水口为2(填1或2);
(2)在该实验中,三口烧瓶的容积最适合的是A(填入正确选项前的字母).
A.50mL B.150mL C.250mL D.500mL
(3)本实验中容易产生烃类化合物的化学反应方程式为:HOCH2CHBrCH2CH3 $→_{△}^{浓H_{2}SO_{4}}$CH2=CHCH2CH3+H2O.
(4)反应液冷却到室温后倒入盛有25mL水的分液漏斗中,振荡静置,得到有机层的操作方法是将分液漏斗颈上的玻璃塞打开,再将分液漏斗下面活塞拧开,使下层液体慢慢沿烧杯壁留下,关闭分液漏斗,将上层有机物从分液漏斗上口倒出.
(5)有机层粗产物依次用12mL水、8mL5%氢氧化钠溶液、8mL水和8mL饱和氯化钙溶液洗涤.用氢氧化钠溶液溶液洗涤的目的是除去产品中的硫酸;用氯化钙溶液洗涤的目的是除去少量的氢氧化钠,且能减少产物的损失.
(6)洗涤完成后,通过以下操作分离、提纯产物,正确的操作顺序是cba(填字母).
a.蒸馏 b.过滤 c.加入无水CaCl2
(7)本实验所得到的正丁醚产率为35.34%.
 正丁醚是惰性溶剂,可用作有机合成反应溶剂.某实验小组利用如下装置(夹持和加热装置均省略)合成正丁醚.发生的反应为:
正丁醚是惰性溶剂,可用作有机合成反应溶剂.某实验小组利用如下装置(夹持和加热装置均省略)合成正丁醚.发生的反应为:2CH3CH2CH2CH2OH$\stackrel{H_{2}SO_{4}}{→}$CH3CH2CH2CH2OCH2CH2CH2CH3+H2O
反应物和产物的相关数据列表如下:
| 化合物 名称 | 密度(g/mL ) | 熔 点(℃) | 沸 点(℃) | 水中溶解性 |
| 正丁醇 | 0.810 | -89.8 | 118.0 | 微溶 |
| 正丁醚 | 0.7689 | -95.3 | 142 | 不溶于水 |
| 备注:正丁醚微溶于饱和氯化钙溶液. | ||||
将反应液冷却到室温后倒入盛有25mL水的分液漏斗中,经过分离、洗涤后再分离提纯可得正丁醚3.4g.回答下列问题:
(1)该实验时球形冷凝管的进水口为2(填1或2);
(2)在该实验中,三口烧瓶的容积最适合的是A(填入正确选项前的字母).
A.50mL B.150mL C.250mL D.500mL
(3)本实验中容易产生烃类化合物的化学反应方程式为:HOCH2CHBrCH2CH3 $→_{△}^{浓H_{2}SO_{4}}$CH2=CHCH2CH3+H2O.
(4)反应液冷却到室温后倒入盛有25mL水的分液漏斗中,振荡静置,得到有机层的操作方法是将分液漏斗颈上的玻璃塞打开,再将分液漏斗下面活塞拧开,使下层液体慢慢沿烧杯壁留下,关闭分液漏斗,将上层有机物从分液漏斗上口倒出.
(5)有机层粗产物依次用12mL水、8mL5%氢氧化钠溶液、8mL水和8mL饱和氯化钙溶液洗涤.用氢氧化钠溶液溶液洗涤的目的是除去产品中的硫酸;用氯化钙溶液洗涤的目的是除去少量的氢氧化钠,且能减少产物的损失.
(6)洗涤完成后,通过以下操作分离、提纯产物,正确的操作顺序是cba(填字母).
a.蒸馏 b.过滤 c.加入无水CaCl2
(7)本实验所得到的正丁醚产率为35.34%.
5.甲酸甲酯水解反应方程式为:HCOOCH3(1)+H2O(1)?HCOOH(1)+CH3OH(1)△H>0某温度下,V L混合体系中各组分的起始量如下表,HCOOCH3转化率随反应时间t的变化如图(假设混合体系体积不变).下列说法正确的是( )

| 组分 | 物质的量/mol |
| HCOOCH3 | 1.00 |
| H2O | 1.99 |
| HCOOH | 0.01 |
| CH3OH | 0.52 |

| A. | 温度升髙,该反应的平衡常数减小 | |
| B. | 0〜10min,HCOOCH3的平均反应速率v=0.003mol•L-1min-1 | |
| C. | HCOOCH3水解平均反应速率先是增大,后减小,最后保持不变 | |
| D. | 该条件下达到平衡状态,反应物转化率相等 |
6.某大学研制成功的新型碱性聚合物电解质燃料电池,有望大幅降低燃料电池汽车的造价.该甲醇燃料电池在NaOH介质中的反应为2CH3OH+3O2+4NaOH═2Na2CO3+6H2O,已知电池的效率与反应速率成正比.不同条件下用不同物质表示的反应速率如下,其中对应的电池效率最高的是( )
| A. | v(CH3OH)=0.3 mol•(L•min)-1 | B. | v(O2)=0.4 mol•(L•min)-1 | ||
| C. | v(NaOH)=0.5 mol•(L•min)-1 | D. | v(Na2CO3)=0.01 mol•(L•s)-1 |