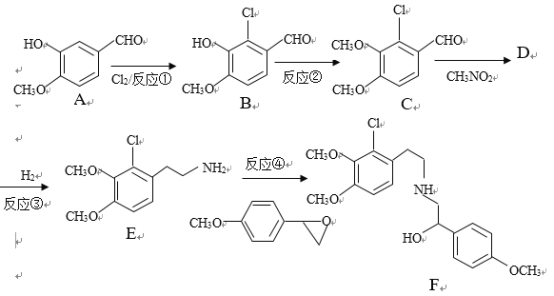
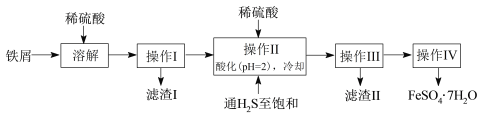
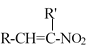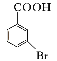��Ŀ����
����Ŀ��������������������Ҫ����������Ʒ���㷺���ڹ�����ʯ�͡���֯��ұ��ʳƷ�ȹ�ҵ������������ָ������������ᣬ ��������ָ�ռ�ʹ���ش��������⣺
(1)д������ϡ����ֱ�������������Һ��Ӧ�����ӷ���ʽ��________
(2)�뽫������������������λ�ڵ������ڵ�Ԫ�أ���ԭ�Ӱ뾶�ɴ�С��˳������_____
(3)�ȵķǽ����Ա���______(����ǿ����������)������������ʵ˵����Ľ���_______
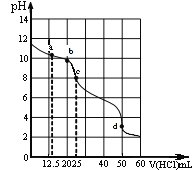
(4)ij�ռ���Һ�к�0.1molNaOH�������Һͨ��һ����CO2����ַ�Ӧ��������Һ�������ɣ��õ��������ɿ���������������ֱ��ǣ�
��_____________________
��Na2CO3��
��_____________________
��NaHCO3��
���ù�������ˮ���μӹ������ᣬ�ٽ���Һ���ɣ��õ������������___g
(5)��Na2CO3����ˮ�õ��������ݣ�
ˮ | Na2CO3 | ���ǰ�¶� | ��Ϻ��¶� |
35ml | 3.2g | 20 | 24.3 |
Na2CO3����ˮ______(����������������)�ȣ�����ܽ������ЧӦ�ĽǶȼ��Խ���_________
(6) Na2CO3��Һ�Լ��Ե�ԭ����(д���ӷ���ʽ) ___________ ��д������Һ�еĵ���غ����ʽ��_______
���𰸡�H+ + OH�� = H2O ��2H+ + CO32�� = H2O + CO2�� Na��S��Cl ǿ Cl2+H2S=S��+2HCl������������Ա����������ǿ(HCl���ȶ��Ա�H2Sǿ) NaOH��Na2CO3 Na2CO3��NaHCO3 5.85 �� Na2CO3����ˮʱ��ˮ�Ϲ��̷ų�������������ɢ�������յ����� CO3 2��+ H2O ![]() HCO3�� + OH�� [Na+]+[H+]=2[CO3 2��]+[HCO3��]+[OH��]
HCO3�� + OH�� [Na+]+[H+]=2[CO3 2��]+[HCO3��]+[OH��]
��������
(1)������Ժ���������֮�䷴Ӧ���������ơ�ˮ�������̼����֮�䷴Ӧ���������ơ�ˮ�Լ�������̼�����ӷ���ʽΪ��H++OH-=H2O��2H++CO32-=H2O+CO2����
(2))������������������λ�ڵ������ڵ�Ԫ�طֱ���Na��S��Cl��������ԭ�Ӱ뾶��С����ԭ�Ӱ뾶��С˳���ǣ�Na��S��Cl��
(3)�ȽϷǽ���Ԫ�صķǽ�����ǿ�����ɸ��ݵ���֮����û���Ӧ����Ӧ����������ˮ��������ԡ��⻯����ȶ��ԵȽǶ��жϣ����ݷ�ӦCl2+H2S=S��+2HCl������������Ա����������ǿ��HCl���ȶ��Ա�H2Sǿ����ʵ���Եõ��ȵķǽ����Ա���ǿ��
(4)��0.1molNaOH����Һ����һ����CO2�������ն�����̼��������ͨ�������̼��������ʱ���������ƹ���������Na2CO3�������ɵõ�NaOH��Na2CO3���ڵ�CO2��NaOH��Һǡ����ȫ��Ӧʱ��������Na2CO3���������ɵõ�Na2CO3���۵�CO2�Թ���ʱ�����벿��Na2CO3��Ӧ����NaHCO3���������ɵõ�Na2CO3��NaHCO3���ܵ�CO2��������ʱ��Na2CO3��ȫת��ΪNaHCO3���������ɵõ�NaHCO3������Һ�������ɵõ���������Ϊ��NaOH��Na2CO3��Na2CO3��Na2CO3��NaHCO3��NaHCO3��
����Na�غ㣬���ù�������ˮ���μӹ������ᣬ�ٽ���Һ���ɣ��õ������Ȼ���0.1mol��������5.85g��
(5)���ݱ������ݿ�֪̼��������ˮ���ȣ�Na2CO3����ˮʱ��ˮ�Ϲ��̷ų�������������ɢ�������յ�����������Na2CO3����ˮΪ���ȷ�Ӧ��
(6)̼����ˮ��Һ�д���̼�����ˮ��CO32��+H2O![]() HCO3��+OH����������Һ�Լ��ԣ���Һ�еĵ���غ�Ϊ[Na+]+[H+]=2[CO32��]+[HCO3��]+[OH��]��
HCO3��+OH����������Һ�Լ��ԣ���Һ�еĵ���غ�Ϊ[Na+]+[H+]=2[CO32��]+[HCO3��]+[OH��]��

 ��У����ϵ�д�
��У����ϵ�д�����Ŀ���±�ΪԪ�����ڱ���һ���֡�
̼ | �� | Y | |
X | �� | Z |
����������
(1)��ԭ�ӵĵ����Ų�ʽΪ_________��ZԪ����Ԫ�����ڱ��е�λ��Ϊ______
(2)�ϱ���ԭ�Ӱ뾶����Ԫ����(дԪ�ط���) _____________����ԭ�ӵĺ������ռ��_____________���������___________���˶�״̬��
(3)������ʵ��˵��YԪ�صķǽ����Ա���Ԫ�صķǽ�����ǿ����______________
a.Y������H2S��Һ��Ӧ����Һ�����
b.��������ԭ��Ӧ�У�1moY���ʱ�1mol���ʵõ��Ӷ�
c.Y������Ԫ�ص���ͼ��⻯�����ȷֽ⣬ǰ�ߵķֽ��¶ȸ�
(4)X��Z��Ԫ�صĵ��ʷ�Ӧ����1molX�ĸۻ�����ָ������£�����687kJ����֪�û�������ۡ��е�ֱ�Ϊ-69���58�棬д����X�ĵ���ʽΪ______________�÷�Ӧ���Ȼ�ѧ����ʽ__________________
(5)����̼��ͬλ����һ��ԭ�ӵ���;___________