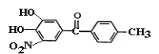
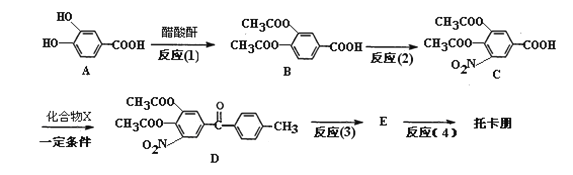
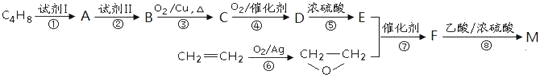
题目内容
【题目】绿矾(FeSO4·7H2O)是治疗缺铁性贫血药品的重要成分。下面是以市售铁屑(含少量锡(Sn)、氧化铁等杂质)为原料生产纯净绿矾的一种方法:
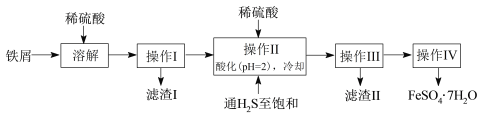
已知:室温下饱和H2S溶液的pH约为3.9,SnS沉淀完全时溶液的pH为1.6;FeS开始沉淀时溶液的pH为3.0,沉淀完全时的pH为5.5。
(1)溶解时需加热,当看到_____________________________________(填现象)时应停止加热,并趁热进行操作I的原因是______________________________________。
(2)操作II中,通入硫化氢至饱和的目的是_______________________________;在溶液中用硫酸酸化至pH= 2的目的是_________________________________。
(3)操作IV的顺序依次为:____________、____________、______________。
操作IV得到的绿矾晶体用少量冰水洗涤,其目的是:①除去晶体表面附着的硫酸等杂质;②_____________________________________________。
(4)测定绿矾产品中Fe2+含量的方法是:a.称取2.850g绿矾产品,溶解,在250 mL容量瓶中定容;b.量取25.00 mL待测溶液于锥形瓶中;c.用硫酸酸化的0.01000 mol/L KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00 mL(滴定时发生反应的离子方程式为:5Fe2++MnO4+8H+→5Fe3++Mn2++4H2O)。
①判断此滴定实验达到终点的方法是_________________________________。
②计算上述样品中FeSO4·7H2O的质量分数为_______(用小数表示,保留三位小数)。
【答案】溶液中气泡较少时 防止FeSO4·7H2O结晶析出损耗 除去溶液中的Sn2+离子,并防止Fe2+被氧化 防止Fe2+离子生成沉淀 蒸发 冷却结晶 过滤 降低洗涤过程中FeSO4·7H2O的损耗 滴加最后一滴KMnO4溶液时,溶液变成浅红色且半分钟内不褪色 0.975
【解析】
铁屑加入稀硫酸生成硫酸亚铁、硫酸锡,过滤后得到滤液,将滤液加入稀硫酸酸化,并通入硫化氢,可生成SnS沉淀并防止亚铁离子被氧化,过滤后得到滤液为硫酸亚铁,经蒸发浓缩、冷却结晶、过滤可得到FeSO47H2O。
(1)铁和锡都可以和稀硫酸反应生成氢气,所以当看到溶液中气泡较少时,说明固体基本反应完全,应停止加热;温度降低FeSO4下降有可能会有FeSO4·7H2O结晶析出,所以要趁热过滤;
(2)通入硫化氢至饱和的目的是:硫化氢具有强还原性,可以防止亚铁离子被氧化,同时生成SnS沉淀将锡离子除去;已知:在H2S饱和溶液中,SnS沉淀完全时溶液的pH为1.6,FeS开始沉淀时溶液的pH为3.0,沉淀完全时的pH为5.5,在溶液pH=2时,Sn2+完全沉淀,亚铁离子不沉淀;
(3)滤液中得到晶体,需要对溶液进行加热蒸发浓缩,结晶析出,过滤洗涤等,所以操作IV的顺序依次为:蒸发浓缩、冷却结晶、过滤;
冰水温度低,物质溶解度减小,可以洗去沉淀表面的杂质离子,同时避免绿矾溶解带来的损失;
(4)①滴定过程中发生反应5Fe2++MnO4+8H+→5Fe3++Mn2++4H2O,滴定终点MnO4不再被还原,溶液呈浅红色,所以滴定终点现象为:滴加最后一滴KMnO4溶液时,溶液变成浅红色且半分钟内不褪色;
②滴定过程中发生反应5Fe2++MnO4+8H+→5Fe3++Mn2++4H2O,消耗KMnO4溶液体积的平均值为20.00 mL,根据方程式可知25mL待测液中n(Fe2+)=5×0.02L×0.01000 mol/L=0.001mol,则250mL待测中n(Fe2+)=0.01mol,即n(FeSO4·7H2O)=0.01mol,所以质量分数为![]() 。
。

【题目】电石中的碳化钙和水能完全反应![]() ,使反应产生的气体排水,测量出水的体积,可计算出标准状况下乙炔的体积,从而测定电石中碳化钙的含量:
,使反应产生的气体排水,测量出水的体积,可计算出标准状况下乙炔的体积,从而测定电石中碳化钙的含量:
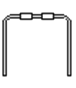
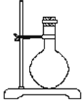
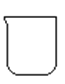
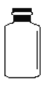
(1)若用下列仪器和导管组装实验装置:
序号 | 1 | 2 | 3 | 4 | 5 | 6 |
导管及仪器 |
|
|
|
|
|
|
每个橡皮塞上都打了两个孔 | ||||||
如果所制气体流向从左向右时,上述仪器和导管从从上到下,从左到右直接连接的顺序(填各仪器,导管的序号) 接 接 接 接 接 。_________
(2)仪器连接好后,进行实验时,有下列操作(每项操作只进行一次)
①称取一定量电石,置于仪器3中,塞紧橡皮塞
②检查装置的气密性
③在仪器6和5中注入适量水
④待仪器3恢复至室温时,量取仪器4中水的体积(导管2中水的体积忽略不计)
⑤慢慢开启仪器6 的活塞,使水逐滴滴下至不发生气体时,关闭活塞。
正确操作顺序(用操作编号填写)是____________________________
(3)若实验中产生的气体存在难闻的气味,且测定结果偏大,这是因为电石中含有杂质气体,可以用___________________(填试剂)加以除去。
【题目】“三酸两碱”是最重要的无机化工产品,广泛用于国防、石油、纺织、冶金、食品等工业。“三酸”是指硝、硫酸和盐酸, “两碱”指烧碱和纯碱。回答下列问题:
(1)写出过量稀硝酸分别与“两碱”溶液反应的离子方程式:________
(2)请将“三酸两碱”中所含位于第三周期的元素,按原子半径由大到小的顺序排列_____
(3)氯的非金属性比硫______(填“强”或“弱”),请用两个事实说明你的结论_______
(4)某烧碱溶液中含0.1molNaOH,向该溶液通入一定量CO2,充分反应后,将所得溶液低温蒸干,得到固体的组成可能有四种情况,分别是:
①_____________________
②Na2CO3;
③_____________________
④NaHCO3。
若该固体溶于水,滴加过量盐酸,再将溶液蒸干,得到固体的质量是___g
(5)将Na2CO3溶于水得到下列数据:
水 | Na2CO3 | 混合前温度 | 混合后温度 |
35ml | 3.2g | 20 | 24.3 |
Na2CO3溶于水______(填“吸”或“放”)热,请从溶解过程热效应的角度加以解释_________
(6) Na2CO3溶液显碱性的原因是(写离子方程式) ___________ ,写出该溶液中的电荷守恒表达式:_______
【题目】下列实验方案、现象、得出的结论均正确的是( )
选项 | 实验及现象 | 结论 |
A | 用酸度计测定 |
|
B | 向待测液中依次滴入氯水和 | 待测溶液中含有 |
C | 向酸化的 | 证明 |
D | 其他条件相同,测定等浓度的 | td style="width:153.75pt; border-top-style:solid; border-top-width:0.75pt; border-left-style:solid; border-left-width:0.75pt; padding:3.38pt 5.62pt; vertical-align:middle">
A.AB.BC.CD.D