题目内容
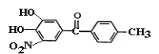
【题目】萜类化合物广泛存在于动植物体内,关于下列萜类化合物的说法正确的是( )
A.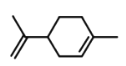 和
和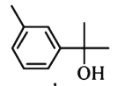 都属于芳香族化合物
都属于芳香族化合物
B. 和
和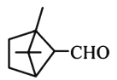 分子中所有碳原子均处于同一平面上
分子中所有碳原子均处于同一平面上
C. 、
、 和
和 均能使酸性
均能使酸性![]() 溶液褪色
溶液褪色
D. 和
和 均能与新制的
均能与新制的![]() 反应生成红色沉淀
反应生成红色沉淀
【答案】C
【解析】
A. 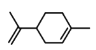 分子中没有苯环,不属于芳香族化合物,A选项错误;
分子中没有苯环,不属于芳香族化合物,A选项错误;
B. 饱和C和与之相连的4个原子形成四面体的空间构型。如图所示: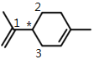 ,分子中以“*”标志的饱和碳原子和与之直接相连的3个碳原子共4个碳原子最多3个C共面,不可能所有碳原子均处于同一平面上,B选项错误;
,分子中以“*”标志的饱和碳原子和与之直接相连的3个碳原子共4个碳原子最多3个C共面,不可能所有碳原子均处于同一平面上,B选项错误;
C. 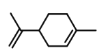 分子中含碳碳双键,
分子中含碳碳双键,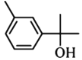 中含-OH以及苯环上连有-CH3,
中含-OH以及苯环上连有-CH3,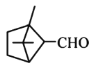 中含醛基,三者都能被酸性KMnO4溶液氧化,使酸性KMnO4被还原而褪色,C选项正确;
中含醛基,三者都能被酸性KMnO4溶液氧化,使酸性KMnO4被还原而褪色,C选项正确;
D. 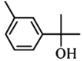 分子中官能团为-OH,属于醇类,不能与新制Cu(OH)2反应,
分子中官能团为-OH,属于醇类,不能与新制Cu(OH)2反应,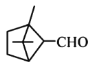 分子中官能团为—CHO,与新制Cu(OH)2共热可产生红色沉淀,D选项错误;
分子中官能团为—CHO,与新制Cu(OH)2共热可产生红色沉淀,D选项错误;
答案选C。

【题目】“三酸两碱”是最重要的无机化工产品,广泛用于国防、石油、纺织、冶金、食品等工业。“三酸”是指硝、硫酸和盐酸, “两碱”指烧碱和纯碱。回答下列问题:
(1)写出过量稀硝酸分别与“两碱”溶液反应的离子方程式:________
(2)请将“三酸两碱”中所含位于第三周期的元素,按原子半径由大到小的顺序排列_____
(3)氯的非金属性比硫______(填“强”或“弱”),请用两个事实说明你的结论_______
(4)某烧碱溶液中含0.1molNaOH,向该溶液通入一定量CO2,充分反应后,将所得溶液低温蒸干,得到固体的组成可能有四种情况,分别是:
①_____________________
②Na2CO3;
③_____________________
④NaHCO3。
若该固体溶于水,滴加过量盐酸,再将溶液蒸干,得到固体的质量是___g
(5)将Na2CO3溶于水得到下列数据:
水 | Na2CO3 | 混合前温度 | 混合后温度 |
35ml | 3.2g | 20 | 24.3 |
Na2CO3溶于水______(填“吸”或“放”)热,请从溶解过程热效应的角度加以解释_________
(6) Na2CO3溶液显碱性的原因是(写离子方程式) ___________ ,写出该溶液中的电荷守恒表达式:_______
【题目】下列实验方案、现象、得出的结论均正确的是( )
选项 | 实验及现象 | 结论 |
A | 用酸度计测定 |
|
B | 向待测液中依次滴入氯水和 | 待测溶液中含有 |
C | 向酸化的 | 证明 |
D | 其他条件相同,测定等浓度的 | td style="width:153.75pt; border-top-style:solid; border-top-width:0.75pt; border-left-style:solid; border-left-width:0.75pt; padding:3.38pt 5.62pt; vertical-align:middle">
A.AB.BC.CD.D
【题目】在一个体积为2L的真空密闭容器中加入0.5molCaCO3,发生反应CaCO3(s)![]() CaO(s)+CO2(g),测得二氧化碳的物质的量浓度随温度的变化关系如图表示,图中A表示CO2的平衡浓度与温度的关系曲线,B表示不同温度下反应经过相同时间时CO2的物质的量浓度的变化曲线。请按要求回答下列问题:
CaO(s)+CO2(g),测得二氧化碳的物质的量浓度随温度的变化关系如图表示,图中A表示CO2的平衡浓度与温度的关系曲线,B表示不同温度下反应经过相同时间时CO2的物质的量浓度的变化曲线。请按要求回答下列问题:
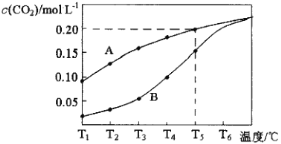
(1)该反应正反应为___(填“吸”或“放”)热反应,温度为T5℃时,该反应耗时40s达到平衡,则T5℃时,该反应的平衡常数数值为___。
(2)如果该反应的平衡常数K值变大,该反应___ (选填编号)。
a.一定向逆反应方向移动 b.在平衡移动时正反应速率先增大后减小
c.一定向正反应方向移动 d.在平衡移动时逆反应速率先减小后增大
(3)请说明随温度的升高,曲线B向曲线A逼近的原因:___。
(4)在T5℃下,维持温度和容器体积不变,向上述平衡体系中再充入0.5molN2,则最后平衡时容器中的CaCO3的质量为___ g。
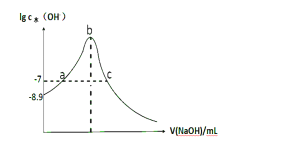
(5)已知苯酚和碳酸的电离平衡常数如图所示。请写出二氧化碳通入苯酚钠溶液的化学反应离子方程式___,请用电离平衡原理解释上述反应发生的原因以及确定生成物的依据___。
物质 | 电离平衡常数(25℃) |
C6H5OH | Ki=1.28×10-10 |
H2CO3 | Ki1=4.3×10-7 |
Ki2=5.6×10-11 |