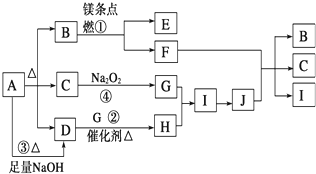
题目内容
19.下列各项表述中正确的是( )| A. | Na2O2中阴离子和阳离子数目比为1:1 | |
| B. | 任何离子键的形成过程都有电子的得失 | |
| C. | 已知C(石墨)=C(金刚石)是吸收能量的反应,由此说明石墨比金刚石稳定 | |
| D. | 通过测量AlCl3溶液的导电性,可判断其为共价化合物 |
分析 A、过氧化钠是钠离子和过氧根离子构成;
B、阴、阳离子的形成不一定有电子的得失,形成离子化合物也不一定有电子得失;
C、能量守恒可知,金刚石能量高于石墨,能量越高约活泼;
D、氯化铝是共价化合物,水溶液中完全电离出自由移动的铝离子和氯离子,溶液导电.
解答 解:A、过氧化钠是钠离子和过氧根离子构成,Na2O2中阴离子和阳离子数目比为1:2,故A错误;
B、阴阳离子之间通过静电作用形成的化学键为离子键,离子键的作用微粒为阴阳离子,阴、阳离子的形成不一定有电子的得失,如铵根中的氮原子与四个氢原子形成四个共价键,形成离子化合物也不一定有电子得失,如发生复分解反应生成离子化合物过程也没有电子转移,NaOH+HCl═NaCl+H2O,离子化合物氯化钠的形成没有电子的得失,故B错误;
C、已知C(石墨)=C(金刚石)是吸收能量的反应,金刚石能量高于石墨,能量越高约活泼,由此说明石墨比金刚石稳定,故C正确;
D、氯化铝是共价化合物,水溶液中完全电离出自由移动的铝离子和氯离子,溶液导电,不能判断为共价化合物,故D错误;
故选C.
点评 本题考查了物质性质的分析应用,主要是钠及其化合物结构个性质分析,注意物质能量越高越活泼,题目难度中等.

练习册系列答案
相关题目
9.下列说法正确的是( )
| A. | 甘油、氨基酸在一定条件下都能发生酯化反应 | |
| B. | 菲的结构简式为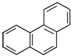 ,它的一硝基取代物共有10种 ,它的一硝基取代物共有10种 | |
| C. | 某有机物分子式为C14H12O2,球棍模型如图所示,此有机物能与NaHCO3溶液反应放出CO2气体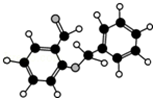 | |
| D. | 分别完全燃烧等物质的量的果糖和蔗糖,消耗的氧气量相等 |
7.下列表示可燃物燃烧热的热化学方程式书写正确的是( )
| A. | P4(白磷、s)+3O2(g)═2P2O3(s)△H=-1638 kJ/mol | |
| B. | CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-802.3 kJ/mol | |
| C. | 2CO(g)+O2(g)═2CO2(g)△H=-566 kJ/mol | |
| D. | H2(g)+1/2O2(g)═H2O(l)△H=-285.8 kJ/mol |
14.下列说法正确的是( )
| A. | 根据是否有丁达尔现象将分散系分为:溶液、胶体、浊液 | |
| B. | 酸性氧化物一定是非金属氧化物 | |
| C. | 强电解质的导电能力一定比弱电解质强 | |
| D. | 双氧水、水玻璃、氯水都是混合物 |
4.下列化学反应中,生成物的总能量高于反应物的总能量的是( )
| A. | Zn与盐酸反应 | B. | CaO与H2O反应 | C. | NaOH与盐酸反应 | D. | C和H2O(g)反应 |
11.科学合理的综合利用海水资源,是开发和利用自然资源的重要方面.下列不需要化学变化就能够从水中获得的物质是( )
| A. | 氯、溴、碘 | B. | 食盐、淡水 | C. | 烧碱、氢气 | D. | 钠、镁、铝 |
8.用CH3CO18OH和CH3H2OH发生酯化反应,对于18O的说法正确的是( )
| A. | 18O存在于乙酸、乙酸乙酯和水中 | B. | 18O只存在于乙醇中 | ||
| C. | 18O只存在于乙酸和水中 | D. | 18O存在于水中 |
9.下列物质中,既存在离子键又存在非极性键的是( )
| A. | H2O2 | B. | MgCl2 | C. | CaC2 | D. | NaOH |