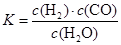题目内容
工业上以氨气为原料(铂铑合金网为催化剂)催化氧化法制硝酸的过程如下:
|
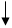

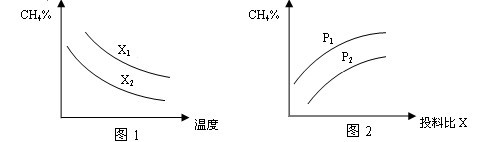
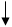 (1)己知反应一经发生,铂铑合金网就会处于红热状态。写出氨催化氧化的化学方程式:______________________________________________;当温度升高时,该反应的平衡常数K值___________(填“增大”、“减小”或“不变”)。
(1)己知反应一经发生,铂铑合金网就会处于红热状态。写出氨催化氧化的化学方程式:______________________________________________;当温度升高时,该反应的平衡常数K值___________(填“增大”、“减小”或“不变”)。(2)硝酸厂尾气常用的处理方法是催化还原法:催化剂存在时用H2将NO2还原为N2。已知:
2H2(g)+O2(g)=2H2O(g) △H= a kJ·mol-1
N2(g)+2O2(g)=2NO2(g) △H= b kJ·mol-1
H2O(1)=H2O(g) △H= c kJ·mol-1
则反应2NO2(g)+4H2(g)=N2(g)+4H2O(1)的△H=_________。(用a、b、c表示)
(3)①合成氨反应的化学方程式为N2+3H2
 2NH3,该反应在固定容积的密闭容器中进行。下列各项标志着该反应达到化学平衡状态的是____________(填序号)
2NH3,该反应在固定容积的密闭容器中进行。下列各项标志着该反应达到化学平衡状态的是____________(填序号)A.容器内N2、H2、NH3的浓度之比为1∶3∶2
B.3v正(N2)=v逆(H2)
C.容器内压强保持不变
D.混合气体的相对分子质量保持不变
E.1mol N≡N键断裂,同时1mol H—H键断裂
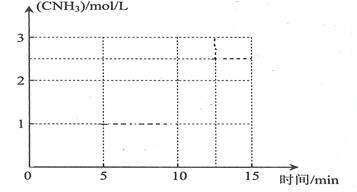
②若在恒温条件下,将N2与H2按一定比例混合通入一个容积为2L的密闭容器中,5min反应达平衡,n(N2)=1mol,n(H2)=1mol,n(NH3)=2mol,则反应速率v(N2)=________________,H2的平衡转化率=_________________;若保持容器的温度不变,在10min时将容器的容积压缩为lL,请在答题卡坐标图中,画出从反应开始至15min时c(NH3)随时间变化曲线示意图。
(16分)
(1)4NH3+5O2 4NO + 6H2O (2分) 减小(2分)
4NO + 6H2O (2分) 减小(2分)
(2)(2a—b—4c)kJ/mol (2分,不写单位扣1分)
(3)①B C D(3分)
②0.1mol/(L·min) (2分,不写或写错单位0分) 75%(2分)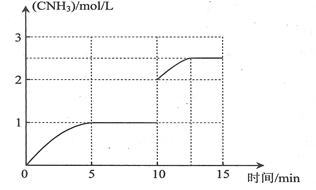
(共3分,前10min的曲线1分;10~15min的曲线2分,到达平衡的时间应小于15min,NH3平衡浓度小于2.67 mol/L)
解析试题分析:(1)氨气具有还原性,与氧气在催化剂加热作用下发生反应,生成一氧化氮和水,该反应是氧化还原反应、可逆反应、放热反应,氮元素由—3升为+2价,氧元素由0降为—2价,根据最小公倍数法配平,则4NH3+5O2 4NO + 6H2O;由于升高温度平衡向吸热方向移动,正反应是放热反应,则升高温度平衡向逆反应方向移动,则生成物浓度减小,反应物浓度增大,所以重新平衡时生成物浓度幂之积与反应物浓度幂之积的比值减小,即升高温度时该反应的平衡常数K减小;(2)先将4个热化学方程式分别编号为①②③④,由于①×2—②—③×4=④,根据盖斯定律,则④的焓变=①的焓变×2—②的焓变—③的焓变×4=(2a—b—4c)kJ/mol;(3)①容器内各组分浓度等于化学方程式的系数比,不能说明反应达到平衡,因为各组分变化浓度之比一定等于系数之比,而平衡浓度不一定等于系数之比,各组分浓度不随时间改变而改变才能说明达到平衡,故A错误;同一物质表示的正、逆反应速率相等,不同物质表示的正、逆反应速率之比等于化学方程式中对应系数之比时,都能说明反应达到平衡,v正(N2)/v逆(H2)=1/3,则3v正(N2)=v逆(H2),故B正确;合成氨是气体物质的量减小的反应,随着反应的进行,容器内混合气体的物质的量逐渐减小,则压强也逐渐减小,当混合气体总的物质的量保持不变或压强不变时,说明反应达到平衡,故C正确;由于各组分都是气体,因此混合气体的总质量始终不变,M=m/n=Mrg/mol,随着反应的进行,由于混合气体的总物质的量逐渐减小,则混合气体摩尔质量逐渐减小或相对分子质量逐渐减小,当混合气体物质的量不变或相对分子质量不变时,反应达到平衡,故D正确;N≡N键断裂、H—H键断裂都是正反应速率,故E错误;②由于氮气、氢气的起始物质的量未知,所以不能直接用定义式求氮气表示的速率,而氨气是生成物,起始时为0,则v(NH3)=
4NO + 6H2O;由于升高温度平衡向吸热方向移动,正反应是放热反应,则升高温度平衡向逆反应方向移动,则生成物浓度减小,反应物浓度增大,所以重新平衡时生成物浓度幂之积与反应物浓度幂之积的比值减小,即升高温度时该反应的平衡常数K减小;(2)先将4个热化学方程式分别编号为①②③④,由于①×2—②—③×4=④,根据盖斯定律,则④的焓变=①的焓变×2—②的焓变—③的焓变×4=(2a—b—4c)kJ/mol;(3)①容器内各组分浓度等于化学方程式的系数比,不能说明反应达到平衡,因为各组分变化浓度之比一定等于系数之比,而平衡浓度不一定等于系数之比,各组分浓度不随时间改变而改变才能说明达到平衡,故A错误;同一物质表示的正、逆反应速率相等,不同物质表示的正、逆反应速率之比等于化学方程式中对应系数之比时,都能说明反应达到平衡,v正(N2)/v逆(H2)=1/3,则3v正(N2)=v逆(H2),故B正确;合成氨是气体物质的量减小的反应,随着反应的进行,容器内混合气体的物质的量逐渐减小,则压强也逐渐减小,当混合气体总的物质的量保持不变或压强不变时,说明反应达到平衡,故C正确;由于各组分都是气体,因此混合气体的总质量始终不变,M=m/n=Mrg/mol,随着反应的进行,由于混合气体的总物质的量逐渐减小,则混合气体摩尔质量逐渐减小或相对分子质量逐渐减小,当混合气体物质的量不变或相对分子质量不变时,反应达到平衡,故D正确;N≡N键断裂、H—H键断裂都是正反应速率,故E错误;②由于氮气、氢气的起始物质的量未知,所以不能直接用定义式求氮气表示的速率,而氨气是生成物,起始时为0,则v(NH3)=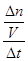 =
= 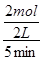 =0.2mol/(L?min);由于v(N2)/ v(NH3)=1/2,则v(N2)= 0.1mol/(L?min);设氮气、氢气的起始物质的量分别为xmol、ymol,则它们的起始浓度分别为x/2mol/L、y/2mol/L,则:
=0.2mol/(L?min);由于v(N2)/ v(NH3)=1/2,则v(N2)= 0.1mol/(L?min);设氮气、氢气的起始物质的量分别为xmol、ymol,则它们的起始浓度分别为x/2mol/L、y/2mol/L,则:
N2 + 3H2  2NH3
2NH3
起始浓度/ mol·L-1 x/2 y/2 0
变化浓度/ mol·L-1 1/2 3/2 1
平衡浓度/ mol·L-1 1/2 1/2 1
则x/2—1/2=1/2,y/2—3/2=1/2,解得:x=2,y=4
氢气的平衡转化率=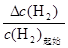 ×100%=
×100%=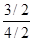 ×100%=75%。
×100%=75%。
画图要点:①t=0时,氨气浓度为0;t=5min,氨气浓度为1mol/L;0<t<5min时,氨气浓度逐渐增大;5min≤t<10min时,氨气浓度始终为1mol/L;②t=10min时,由于容器容积缩小1半,则反应物、生成物浓度立即增大一倍,则氨气浓度变为2mol/L;③缩小容器容积,就是增大压强,反应速率增大,达到平衡的时间大约是起始时达到平衡时间的一半,因此达到平衡的时间约为5/2min;若正反应能进行到底,氮气过量,4mol氢气最多可以生成8/3mol氨气,由于可逆反应不能进行到底,则浓度一定小于8/3mol/L≈2.67mol/L;10min<t≤12.5min时,由于正反应是气体体积减小的反应,增大压强平衡向正反应方向移动,所以氨气浓度从2mol/L逐渐增大到2.5mol/L左右;④12.5min<t≤15min时,氨气浓度始终为2.5mol/L左右。
考点:考查化学反应原理,涉及氨催化氧化的化学方程式、盖斯定律、化学平衡状态的标志、平均反应速率、平衡转化率、画出反应速率和化学平衡图像等。

(14分)研究CO2与CH4的反应使之转化为CO和H2,对减缓燃料危机,减少温室效应具有重要的意义。
(1)已知:①2CO(g)+O2(g)=2CO2(g) △H=-566 kJ·mol-1
②2H2(g)+O2(g)=2H2O(g) △H=-484kJ·mol-1
③CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-802kJ·mol-1
则CH4(g)+CO2(g)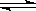 2CO(g)+2H2(g) △H= kJ·mol-1
2CO(g)+2H2(g) △H= kJ·mol-1
(2)在密闭容器中通入物质的量浓度均为0.1mol·L-1的CH4与CO2,在一定条件下发生反应CH4(g)+CO2(g)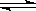 2CO(g)+2H2(g),测得CH4的平衡转化率与温度、压强的关系如下图所示。
2CO(g)+2H2(g),测得CH4的平衡转化率与温度、压强的关系如下图所示。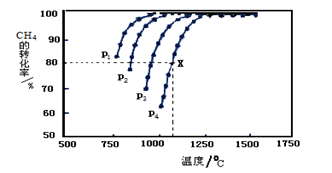
?据图可知,P1、P2、 P3、P4由大到小的顺序 。
?在压强为P4、1100℃的条件下,该反应5min时达到平衡点X,则用CO表示该反应的速率为 。该温度下,反应的平衡常数为 。
(3)CO和H2在工业上还可以通过反应C(s)+H2O(g) 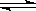 CO(g)+H2 (g)来制取。
CO(g)+H2 (g)来制取。
①在恒温恒容下,如果从反应物出发建立平衡,可认定平衡已达到的是
| A.体系压强不再变化 | B.H2与CO的物质的量之比为1 :1 |
| C.混合气体的密度保持不变 | D.气体平均相对分子质量为15,且保持不变 |
2.2molH2(g)和一定量的C(s),如果此时对体系加压,平衡向 (填“正”或“逆”)反应方向移动,第5min时达到新的平衡,请在下图中画出2~5min内容器中气体平均相对分子质量的变化曲线。
某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“条件对化学反应速率的影响”。实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢。该小组设计了如下的方案。
| 编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度/℃ | ||
| 浓度/ mol?L-1 | 体积/mL | 浓度/ mol?L-1 | 体积/mL | ||
| ① | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
| ② | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
| ③ | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
(1)已知反应后H2C2O4转化为CO2逸出,KMnO4转化为MnSO4,每消耗1mol H2C2O4转移_____mol 电子。为了观察到紫色褪去,H2C2O4与KMnO4初始的物质的量需要满足的关系为:c(H2C2O4)∶c(KMnO4) ≥______________。
(2)探究温度对化学反应速率影响的实验编号是___________(填编号,下同),可探究反应物浓度对化学反应速率影响的实验编号是_____________。
(3)实验①测得KMnO4溶液的褪色时间为40s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(KMnO4)=_______________ mol?L-1?min-1。
(4)已知50℃时c(MnO4-)~反应时间t的变化曲线如图。若保持其他条件不变,请在答题卡坐标图中,画出25℃时c(MnO4-)~t的变化曲线示意图。

(7分)为了研究外界条件对过氧化氢分解速率的影响,某同学做了以下实验:
| 编号 | 操作 | 实验现象 |
| ① | 分别在试管A、B中加入5 mL 5% H2O2溶液,各滴入2滴1 mol·L-1 FeCl3溶液。待试管中均有适量气泡出现时,将试管A放入盛有5℃左右冷水的烧杯中浸泡;将试管B放入盛有40℃左右热水的烧杯中浸泡 | 试管A中无明显气泡产生; 试管B中产生的气泡量增加 |
| ② | 另取两支试管分别加入5 mL 5% H2O2溶液和5 mL 10% H2O2溶液 | 试管A、B中均未明显见到有气泡产生 |
(1)过氧化氢分解的化学方程式为 。
(2)实验①的目的是___________________________________________________;实验中滴加FeCl3溶液的目的是________________________________________。
(3)实验②未观察到预期的实验现象。为了帮助该同学达到实验目的,你提出的对上述操作的改进意见是_________________________(用实验中所提供的试剂或条件)。
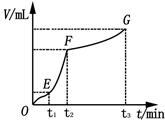
(4)某同学在50 mL一定浓度的H2O2溶液中加入一定量的二氧化锰,放出气体的体积(标准状况下)与反应时间的关系如下图所示,分析判断OE、EF、FG三段中,___________段化学反应速率最快。
(15分) 某同学设计了如下图所示装置(部分夹持装置已略去),该装置可以用来进行多项
实验研究。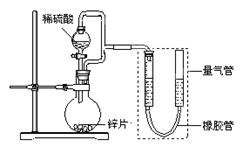
请回答:
(1)用上述装置探究影响化学反应速率的因素。
①圆底烧瓶中发生反应的离子方程式是 。
②用上述装置进行实验,以生成9.0 mL气体为计时终点,结果为t1>t2。
| 序号 | V(H2SO4)/mL | c(H2SO4)/mol·L-1 | t/s |
| Ⅰ | 40 | 1 | t1 |
| Ⅱ | 40 | 4 | t2 |
比较实验Ⅰ和Ⅱ可以得出的实验结论是 。
③若将锌片换成含杂质的粗锌片,且控制其他条件使其与上述实验完全一致,所测得的反应速率均大于上述实验对应的数据。粗锌片中所含杂质可能是(填序号) 。
a.石墨 b.银 c.铜 d.沙粒(二氧化硅)
(2)用上述装置测定粗锌片的纯度。
①连接好装置,检查装置气密性,称量粗锌片mg置于圆底烧瓶中,滴加足量稀硫酸,充分反应直至不再产生气体为止,测得气体体积为VL,则粗锌片的纯度为 。
②本实验在读数前对量气管的操作是 。
③本套装置中若考虑滴入的稀硫酸的体积(假设其它操作都正确),则测得的气体的体积将 。(填“偏大”、“偏小”或“无影响”,)
(3)用上述装置验证生铁在潮湿空气中会发生吸氧腐蚀。
①圆底烧瓶中的试剂可选用(填序号) 。
a.NH4Cl溶液 b.C2H5OH c.Na2CO3溶液 d.稀硫酸
②能证明生铁在潮湿空气中会发生吸氧腐蚀的现象是 。
 x Q(g)+3R(g),经2min达平衡,生成2.4molR,并测得Q的浓度为0.4mol/L。求:
x Q(g)+3R(g),经2min达平衡,生成2.4molR,并测得Q的浓度为0.4mol/L。求: 2C达到平衡。经测定,平衡时c(A2)=0.5mol/L,c(B2)=0.1mol/L,c(C)=1.6mol/L,若A2、B2和C的起始浓度分别为amol/L,bmol/L,cmol/L。
2C达到平衡。经测定,平衡时c(A2)=0.5mol/L,c(B2)=0.1mol/L,c(C)=1.6mol/L,若A2、B2和C的起始浓度分别为amol/L,bmol/L,cmol/L。 CO2(g)+H2(g),已知CO(g)和H2O(g)的起始浓度均为2mol·L-1,经测定该反应在该温度下的平衡常数K=1,试判断:
CO2(g)+H2(g),已知CO(g)和H2O(g)的起始浓度均为2mol·L-1,经测定该反应在该温度下的平衡常数K=1,试判断: