��Ŀ����
��7�֣�Ϊ���о���������Թ�������ֽ����ʵ�Ӱ�죬ijͬѧ��������ʵ�飺
| ��� | ���� | ʵ������ |
| �� | �ֱ����Թ�A��B�м���5 mL 5% H2O2��Һ��������2��1 mol��L��1 FeCl3��Һ�����Թ��о����������ݳ���ʱ�����Թ�A����ʢ��5��������ˮ���ձ��н��ݣ����Թ�B����ʢ��40��������ˮ���ձ��н��� | �Թ�A�����������ݲ����� �Թ�B�в��������������� |
| �� | ��ȡ��֧�Թֱܷ����5 mL 5% H2O2��Һ��5 mL 10% H2O2��Һ | �Թ�A��B�о�δ���Լ��������ݲ��� |
��1����������ֽ�Ļ�ѧ����ʽΪ �������������� ��
��2��ʵ��ٵ�Ŀ����___________________________________________________��ʵ���еμ�FeCl3��Һ��Ŀ����________________________________________��
��3��ʵ���δ�۲쵽Ԥ�ڵ�ʵ������Ϊ�˰�����ͬѧ�ﵽʵ��Ŀ�ģ�������Ķ����������ĸĽ������_________________________����ʵ�������ṩ���Լ�����������
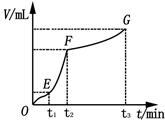
��4��ijͬѧ��50 mLһ��Ũ�ȵ�H2O2��Һ�м���һ�����Ķ������̣��ų�������������״���£��뷴Ӧʱ��Ĺ�ϵ����ͼ��ʾ�������ж�OE��EF��FG�����У�___________�λ�ѧ��Ӧ������졣
��1��2H2O2  2H2O+O2����1�֣� ��2���о��¶ȶ�H2O2�ֽ����ʵ�Ӱ�죨1�֣�
2H2O+O2����1�֣� ��2���о��¶ȶ�H2O2�ֽ����ʵ�Ӱ�죨1�֣�
��Ϊ�������ӿ�H2O2�ֽ����� ��1�֣�
��3������֧�Թ�ͬʱ����ʢ����ͬ�¶���ˮ���ձ��У�������֧�Թ���ͬʱ����2��1mol��L��1 FeCl3��Һ�����۲�������ݵ����ʣ�2�֣� ��4��EF��2�֣�
���������������1����������ֽ⣬���������ڴ˷�Ӧ����������������ã��ܼӿ��������ֽ�������������ʣ��ʴ�Ϊ��2H2O2  2H2O+O2����
2H2O+O2����
��2���ֱ����Թ�A��B�м��� 5mL 5% H2O2��Һ��������1��2 ��1mol/L FeCl3��Һ�����Թ��о����������ݳ��֣�˵����������ֽ��ܷ������Թ�A��B�о����������ݳ���ʱ�����Թ�A����ʢ��5��������ˮ���ձ��У����Թ�B����ʢ��40��������ˮ���ձ��У���֧�Թܲ�ͬ�����Թ�A���¶ȱ��Թ�B���¶ȵͣ�˵���о������¶ȶԷ�Ӧ���ʵ�Ӱ�죬����ʼ�ӵμ�FeCl3��Һ��Ŀ�ļӿ�H2O2�ֽ⣬�ʴ�Ϊ���о��¶ȶ�H2O2�ֽ����ʵ�Ӱ�죻�ӿ�H2O2�ֽ����ʣ�ʹʵ���������ڹ۲죻
��3��Ӱ�컯ѧ��Ӧ���ʵ����������Ũ�ȡ��¶ȡ������ѹǿ������������ı��������ȡ��֧�Թֱܷ���� 5mL 5%H2O2��Һ�� 5mL10%H2O2��Һ���Թ�A��B�о�δ�����ݲ�����Ϊ�ӿ췴Ӧ���ʣ��ɴ��¶ȡ��������Ӱ��Ƕȿ��ǣ��ʴ�Ϊ������֧�Թ�ͬʱ����ʢ����ͬ�¶���ˮ���ձ��У�������֧�Թ���ͬʱ����2��1mol/L FeCl3��Һ���۲�������ݵ����ʣ�
��4����ͼ��������ʾʱ�䣬�������ʾ��������������ʱ��Խ�����ɵ�����Խ�࣬��Ӧ����Խ�죬���ߵ�б��Խ����������������EF�Ρ�
���㣺������������Է�Ӧ���ʵ�Ӱ���Լ�ѧ����ʵ��̽������

 ͬ������ϵ�д�
ͬ������ϵ�д���8�֣���200mL 6mol��L-1�����м���һ�����Ĵ���CaCO3����������������ʱ��ı仯������ͼ��ʾ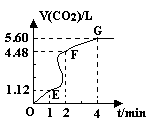 ������������ڱ�״���²ⶨ������ش��������⣺
������������ڱ�״���²ⶨ������ش��������⣺
��1����OE�εķ�Ӧ����Ϊv1��EF�εķ�Ӧ����Ϊv2��
FG�εķ�Ӧ����Ϊv3���� Ӱ��v1��v2��v3��Ӧ���ʵ������� ��
��2��Ϊ�˼���������Ӧ�����ʣ��������Һ�м����������ʣ�����Ϊ���е��� ������ĸ��
| A������ˮ | B���Ȼ��ع��� | C���Ȼ�����Һ | D��Ũ���� |
 ��3������CaCO3������Ϊ ��
��3������CaCO3������Ϊ ����4������Ӧ��������Һ����ı仯���Բ��ƣ���EF���������ʾ�Ļ�ѧ��Ӧ����V��HCl��=______��
��ҵ������Ϊԭ��(����Ͻ���Ϊ����)��������������Ĺ������£�
|

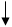 ��1����֪��Ӧһ������������Ͻ����ͻᴦ�ں���״̬��д�����������Ļ�ѧ����ʽ��______________________________________________�����¶�����ʱ���÷�Ӧ��ƽ�ⳣ��Kֵ___________(���������С�����䡱)��
��1����֪��Ӧһ������������Ͻ����ͻᴦ�ں���״̬��д�����������Ļ�ѧ����ʽ��______________________________________________�����¶�����ʱ���÷�Ӧ��ƽ�ⳣ��Kֵ___________(���������С�����䡱)����2�����᳧β�����õĴ��������Ǵ���ԭ������������ʱ��H2��NO2��ԭΪN2����֪��
2H2(g)+O2(g)=2H2O(g) ��H= a kJ��mol��1
N2(g)+2O2(g)=2NO2(g) ��H= b kJ��mol��1
H2O(1)=H2O(g) ��H= c kJ��mol��1
��Ӧ2NO2(g)+4H2(g)=N2(g)+4H2O(1)�ġ�H=_________��(��a��b��c��ʾ)
��3���ٺϳɰ���Ӧ�Ļ�ѧ����ʽΪN2+3H2
 2NH3���÷�Ӧ�ڹ̶��ݻ����ܱ������н��С����и����־�Ÿ÷�Ӧ�ﵽ��ѧƽ��״̬����____________(�����)
2NH3���÷�Ӧ�ڹ̶��ݻ����ܱ������н��С����и����־�Ÿ÷�Ӧ�ﵽ��ѧƽ��״̬����____________(�����)A��������N2��H2��NH3��Ũ��֮��Ϊ1��3��2
B��3v��(N2)=v��(H2)
C��������ѹǿ���ֲ���
D������������Է����������ֲ���
E��1mol N��N�����ѣ�ͬʱ1mol H��H������
�����ں��������£���N2��H2��һ���������ͨ��һ���ݻ�Ϊ2L���ܱ������У�5min��Ӧ��ƽ�⣬n(N2)=1mol��n(H2)=1mol��n(NH3)=2mol����Ӧ����v(N2)=________________��H2��ƽ��ת����=_________________���������������¶Ȳ��䣬��10minʱ���������ݻ�ѹ��ΪlL�����ڴ������ͼ�У������ӷ�Ӧ��ʼ��15minʱc(NH3)��ʱ��仯����ʾ��ͼ��
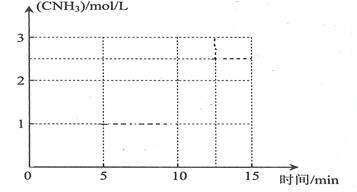
����β���к���CO��NO2���ж����壬��������װβ������װ�ã���ʹ�ж��������Ӧת��Ϊ�����塣
��1������β����CO��NO2������һ�������¿��Է�����Ӧ��
4CO(g)+2NO2(g) 4CO2(g)+N2(g)����H=��1200 kJ��mol��1
4CO2(g)+N2(g)����H=��1200 kJ��mol��1
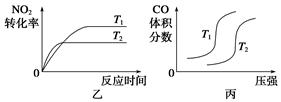
�ٺ��º��������£�����˵���÷�Ӧ�Ѵﵽƽ��״̬����________(�����)��
A�������ڻ��������ɫ���ٱ仯 B�������ڵ�ѹǿ���ֲ���
C��2v��(NO2)=v��(N2) D�������ڻ�������ܶȱ��ֲ���
����ʹ�÷�Ӧ�ķ�Ӧ����������ƽ�����淴Ӧ�����ƶ�����________(�����)��
A����ʱ�����CO2 B���ʵ������¶�
C����С�������ʹ��ϵѹǿ���� D��ѡ���Ч����
�۶��ڸ÷�Ӧ���¶Ȳ�ͬ(T2>T1)������������ͬʱ������ͼ����ȷ����________(�����)��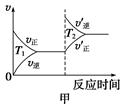
��2������β����CO��H2O(g)��һ�������¿��Է�����Ӧ��CO(g)+H2O(g) CO2(g)+H2(g) ��H<0��820 ��ʱ�ڼס��ҡ������������ܱ������У���ʼʱ�����ұ�����Ͷ�ϣ��ﵽƽ��״̬ʱK=1.0��
CO2(g)+H2(g) ��H<0��820 ��ʱ�ڼס��ҡ������������ܱ������У���ʼʱ�����ұ�����Ͷ�ϣ��ﵽƽ��״̬ʱK=1.0��
| ��ʼ���ʵ��� | �� | �� | �� |
| n(H2O)/mol | 0.10 | 0.20 | 0.20 |
| n(CO)/mol | 0.10 | 0.10 | 0.20 |
�ٸ÷�Ӧ��ƽ�ⳣ������ʽΪ___________��ƽ��ʱ����������CO��ת����= ��
��ƽ��ʱ���Ƚ�����������CO��ת���ʣ��� ��(�>������=����<������ͬ)���� �ס�
ij̽��С���ý������ֱ���ϡ�����ϡ���ᷴӦ�ķ����о������벻ͬ�ᷴӦ�IJ��켰Ӱ�췴Ӧ�ٶȵ����ء�
ʵ��ҩƷ��2.0 mol/L���ᡢ4.0 mol/L���ᡢ2.0 mol/L���ᡢ4.0 mol/L���ᡢ��ͬ��С����Ƭ������(������������Ĥ���ѳ�ȥ)��ÿ��ʵ��������������Ϊ50.0 mL������������Ϊ9.0 g��
��.��ͬѧ����Ƭ�ֱ��ϡ���ᡢϡ���ᷴӦ��ʵ�鼰���������£�
| ��Ӧ���� (����) | 1 | 2 | 5 | 15 | 20 |
| 4.0 mol/L ���� | �������� | �϶����� | �������� | ��Ӧ���� | ��Ƭ�ľ� |
| 2.0 mol/L ���� | ���������� | ������ ���� | �������� | ||
| 4.0 mol/L ���� | ���������� | �������� | �бȽ����������� | ||
��ش��������⣺
(1)д���������ᷴӦ�����ӷ���ʽ�� ��
(2)��Ӧ��1��15min�ڣ���������ķ�Ӧ������������ԭ���� ��
(3)��������̽��������ϡ�����ϡ����ķ�Ӧ���ʴ��ڲ����ԭ�����ܶ�ԭ��������Щ�������룺 (д��һ�ּ���)��
��.��ͬѧ���������Ӱ�췴Ӧ�������ص�ʵ�顣�������ʵ��Ŀ�İ�����ͬѧ�������ʵ����Ʊ���
| ʵ��Ŀ�� | ʵ�� ��� | �¶� /�� | �������� ��̬ | ����Ũ�� /mol��L��1 |
| 1.ʵ��ٺ͢�̽������Ũ�ȶԸ÷�Ӧ���ʵ�Ӱ�죻 2��ʵ��ٺ͢�̽���¶ȶԸ÷�Ӧ���ʵ�Ӱ�죻 3��ʵ��ٺ͢�̽���������(��Ƭ�� ����)�Ը÷�Ӧ���ʵ�Ӱ�� | �� | 25 | ��Ƭ | 4.0 |
| �� | | | | |
| �� | | | | |
| �� | | | |
Fenton�������ڴ������ѽ����л���Ĺ�ҵ��ˮ��ͨ�����ڵ��ں�PH��Fe2+Ũ�ȵķ�ˮ�м���H2O2�����������ǻ����ɻ�������������Ⱦ������ø÷��������л���Ⱦ��p-CP��̽���й����ضԸý��ⷴӦ���ʵ�Ӱ�졣
��ʵ����ơ�����p-CP�ij�ʼŨ����ͬ���㶨ʵ���¶���298K��313K������ʵ���������±�����������¶Ա����顣
��1�����������ʵ����Ʊ������в�Ҫ���ո�
| ʵ�� ��� | ʵ��Ŀ�� | T/K | pH | c/10-3mol��L-1 | |
| H2O2 | Fe2+ | ||||
| �� | Ϊ����ʵ�����ο� | 298 | 3 | 6.0 | 0.30 |
| �� | ̽���¶ȶԽ��ⷴӦ���ʵ�Ӱ�� | | | | |
| �� | | 298 | 10 | 6.0 | 0.30 |
�����ݴ�����ʵ����p-CP��Ũ����ʱ��仯�Ĺ�ϵ����ͼ��
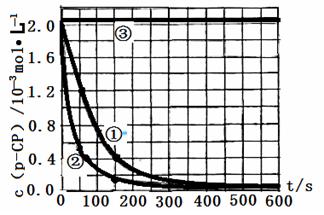
��2���������ͼʵ������ߣ����㽵�ⷴӦ��50~150s�ڵķ�Ӧ���ʣ�
�ԣ�p-CP��= mol��L-1��s-1
��3��ʵ��١��ڱ����¶����ߣ����ⷴӦ���������¶ȹ���ʱ�������½��ⷴӦ���ʼ�С�����Fenton�������Լ�H2O2�ĽǶȷ���ԭ��
��
��4��ʵ��۵ó��Ľ����ǣ�pH����10ʱ�� ��
��5��ʵ��ʱ���ڲ�ͬʱ��ӷ�Ӧ����ȡ������ʹ��ȡ��Ʒ�еķ�Ӧ����ֹͣ������������ͼ�е���Ϣ������һ��Ѹ��ֹͣ��Ӧ�ķ��� ��
�����й��������ε�ˮ���ص��ǣ� ��
| A��NH4Cl��ZnCl2��Һ�������ӽ���ʱ�ij���� |
| B����NaHCO3��Al2(SO4)3������Һ���Ƴ���ĭ���� |
| C�������²��NaHSO3��Һ��pHС��7 |
| D��ʵ����ʢ��Na2CO3��Һ���Լ�ƿ������ĥ�ڲ����� |

 8Na2CrO4+2Fe2O3+8CO2
8Na2CrO4+2Fe2O3+8CO2