题目内容
(14分)研究CO2与CH4的反应使之转化为CO和H2,对减缓燃料危机,减少温室效应具有重要的意义。
(1)已知:①2CO(g)+O2(g)=2CO2(g) △H=-566 kJ·mol-1
②2H2(g)+O2(g)=2H2O(g) △H=-484kJ·mol-1
③CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-802kJ·mol-1
则CH4(g)+CO2(g)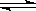 2CO(g)+2H2(g) △H= kJ·mol-1
2CO(g)+2H2(g) △H= kJ·mol-1
(2)在密闭容器中通入物质的量浓度均为0.1mol·L-1的CH4与CO2,在一定条件下发生反应CH4(g)+CO2(g)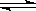 2CO(g)+2H2(g),测得CH4的平衡转化率与温度、压强的关系如下图所示。
2CO(g)+2H2(g),测得CH4的平衡转化率与温度、压强的关系如下图所示。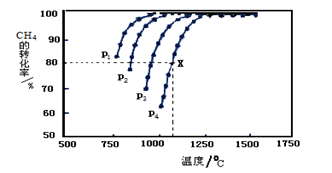
?据图可知,P1、P2、 P3、P4由大到小的顺序 。
?在压强为P4、1100℃的条件下,该反应5min时达到平衡点X,则用CO表示该反应的速率为 。该温度下,反应的平衡常数为 。
(3)CO和H2在工业上还可以通过反应C(s)+H2O(g) 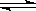 CO(g)+H2 (g)来制取。
CO(g)+H2 (g)来制取。
①在恒温恒容下,如果从反应物出发建立平衡,可认定平衡已达到的是
| A.体系压强不再变化 | B.H2与CO的物质的量之比为1 :1 |
| C.混合气体的密度保持不变 | D.气体平均相对分子质量为15,且保持不变 |
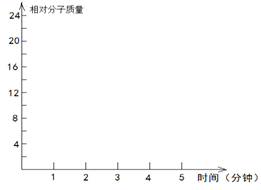
2.2molH2(g)和一定量的C(s),如果此时对体系加压,平衡向 (填“正”或“逆”)反应方向移动,第5min时达到新的平衡,请在下图中画出2~5min内容器中气体平均相对分子质量的变化曲线。
(1)+248
(2)①P4> P3> P2> P1;②0.032mol?L-1?min-1 ; 1.64 ;(3)① AC ② 逆
解析试题分析:(1)③-①-②,整理可得CH4(g)+CO2(g)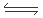 2CO(g)+2H2(g) △H=+248KJ/mol。(2)①据图可知,甲烷在P1、P2、 P3、P4的转化率的关系是P1 > P2> P3> P4。由于反应CH4(g)+CO2(g)
2CO(g)+2H2(g) △H=+248KJ/mol。(2)①据图可知,甲烷在P1、P2、 P3、P4的转化率的关系是P1 > P2> P3> P4。由于反应CH4(g)+CO2(g) 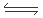 2CO(g)+2H2(g)的正反应是气体体积增大的反应,根据平衡移动原理,减小压强,平衡向气体体积增大的反应方向即向正反应方向移动。所以这几种条件下的压强由大到小的顺序P4> P3> P2> P1。②在压强为P4、1100℃的条件下,该反应5min时达到平衡点X,此时甲烷的转化率为80%,所以c(CO)=2×0.08=0.16mol/L则v(CO)=" 0.016mol/L÷5min=0.032mol/(L·min)." 该温度下,反应的平衡常数为
2CO(g)+2H2(g)的正反应是气体体积增大的反应,根据平衡移动原理,减小压强,平衡向气体体积增大的反应方向即向正反应方向移动。所以这几种条件下的压强由大到小的顺序P4> P3> P2> P1。②在压强为P4、1100℃的条件下,该反应5min时达到平衡点X,此时甲烷的转化率为80%,所以c(CO)=2×0.08=0.16mol/L则v(CO)=" 0.016mol/L÷5min=0.032mol/(L·min)." 该温度下,反应的平衡常数为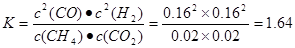 .(3)① A.由于该反应是反应前后气体体积不等的反应,若反应未达到平衡,则容器的压强就要发生变化,所以体系压强不再变化,能证明反应达到平衡。正确。B.在任何时刻都存在关系:H2与CO的物质的量之比为1 :1,因此不能作为判断平衡的标志。错误。C.由于反应物有固体参加,若反应未达到平衡,则气体的密度就要增大或减小,若达到平衡,气体的密度就不会发生变化。因此混合气体的密度保持不变可以证明反应达到平衡的标志。正确。D. 若气体完全是CO与氢气,由于生成的二者的物质的量的比为1:1,气体平均相对分子质量为15,若气体完全是水蒸气,则气体的相对分子质量为18,由于可逆反应达到平衡状态时是三者的共同体,所以气体的平均相对分子质量应该在15~18,且保持不变。错误。②对于C(s)+H2O(g)
.(3)① A.由于该反应是反应前后气体体积不等的反应,若反应未达到平衡,则容器的压强就要发生变化,所以体系压强不再变化,能证明反应达到平衡。正确。B.在任何时刻都存在关系:H2与CO的物质的量之比为1 :1,因此不能作为判断平衡的标志。错误。C.由于反应物有固体参加,若反应未达到平衡,则气体的密度就要增大或减小,若达到平衡,气体的密度就不会发生变化。因此混合气体的密度保持不变可以证明反应达到平衡的标志。正确。D. 若气体完全是CO与氢气,由于生成的二者的物质的量的比为1:1,气体平均相对分子质量为15,若气体完全是水蒸气,则气体的相对分子质量为18,由于可逆反应达到平衡状态时是三者的共同体,所以气体的平均相对分子质量应该在15~18,且保持不变。错误。②对于C(s)+H2O(g)  CO(g)+H2 (g),若增大压强,根据平衡移动原理,应该向气体体积减小的方向就是向逆反应方向移动。在第2分钟时混合气体的平均相对分子质量为:
CO(g)+H2 (g),若增大压强,根据平衡移动原理,应该向气体体积减小的方向就是向逆反应方向移动。在第2分钟时混合气体的平均相对分子质量为: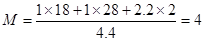 。第5min时达到新的平衡,假如生成物完全转化为反应物,则混合气体的物质的量减小1mol,质量减轻12g,所以混合气体的相对分子质量不变,的平均相对分子质量仍然是12。2~5min内容器中气体平均相对分子质量的变化曲线如图:
。第5min时达到新的平衡,假如生成物完全转化为反应物,则混合气体的物质的量减小1mol,质量减轻12g,所以混合气体的相对分子质量不变,的平均相对分子质量仍然是12。2~5min内容器中气体平均相对分子质量的变化曲线如图: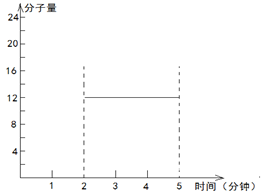 。
。
考点:考查盖斯定律的应用、化学反应速率的计算、化学平衡常数的表达式、化学平衡状态的判断、影响化学平衡的因素、相对分子质量与压强的关系的知识。

(1)固定和利用CO2能有效地利用资源,并减少空气中的温室气体。工业上有一种用CO2来生产甲醇燃料的方法:CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H=-49.0kJ·mol-1。某科学实验将6molCO2和8molH2充入2L密闭容器中,测得H2的物质的量随时间变化如右图所示(实线)。图中数据a(1,6)代表的意思是:在l min时H2的物质的量是6mol。
CH3OH(g)+H2O(g)△H=-49.0kJ·mol-1。某科学实验将6molCO2和8molH2充入2L密闭容器中,测得H2的物质的量随时间变化如右图所示(实线)。图中数据a(1,6)代表的意思是:在l min时H2的物质的量是6mol。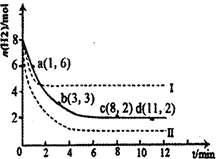
①下列时间段平均反应速率最大的是__________,最小的是______________。
| A.0~1min | B.1~3min | C.3~8min | D.8~11min |
(2)利用光能和光催化剂,可将CO2和H2O(g)转化为CH4和O2。紫外光照射时,等量的CO2和H2O(g)在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下,CH4产量随光照时间的变化如图所示。在0~30 h内,CH4的平均生成速率v(Ⅰ)、v(Ⅱ)和v(Ⅲ)从大到小的顺序为 。反应开始后的12小时内,在第___________种催化剂的作用下,收集的CH4最多。

(8分)向200mL 6mol·L-1盐酸中加入一定量的纯净CaCO3,产生气体的体积随时间的变化曲线如图所示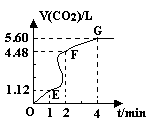 (气体体积均在标准状况下测定)。请回答下列问题:
(气体体积均在标准状况下测定)。请回答下列问题:
(1)设OE段的反应速率为v1,EF段的反应速率为v2,
FG段的反应速率为v3,则 影响v1、v2、v3反应速率的因素是 ;
(2)为了减缓上述反应的速率,欲向该溶液中加入下列物质,你认为可行的是 (填字母)
| A.蒸馏水 | B.氯化钾固体 | C.氯化钠溶液 | D.浓盐酸 |
 (3)加入CaCO3的质量为 。
(3)加入CaCO3的质量为 。(4)若反应过程中溶液体积的变化忽略不计,则EF段用盐酸表示的化学反应速率V(HCl)=______。
工业上以氨气为原料(铂铑合金网为催化剂)催化氧化法制硝酸的过程如下:
|

 (1)己知反应一经发生,铂铑合金网就会处于红热状态。写出氨催化氧化的化学方程式:______________________________________________;当温度升高时,该反应的平衡常数K值___________(填“增大”、“减小”或“不变”)。
(1)己知反应一经发生,铂铑合金网就会处于红热状态。写出氨催化氧化的化学方程式:______________________________________________;当温度升高时,该反应的平衡常数K值___________(填“增大”、“减小”或“不变”)。(2)硝酸厂尾气常用的处理方法是催化还原法:催化剂存在时用H2将NO2还原为N2。已知:
2H2(g)+O2(g)=2H2O(g) △H= a kJ·mol-1
N2(g)+2O2(g)=2NO2(g) △H= b kJ·mol-1
H2O(1)=H2O(g) △H= c kJ·mol-1
则反应2NO2(g)+4H2(g)=N2(g)+4H2O(1)的△H=_________。(用a、b、c表示)
(3)①合成氨反应的化学方程式为N2+3H2
 2NH3,该反应在固定容积的密闭容器中进行。下列各项标志着该反应达到化学平衡状态的是____________(填序号)
2NH3,该反应在固定容积的密闭容器中进行。下列各项标志着该反应达到化学平衡状态的是____________(填序号)A.容器内N2、H2、NH3的浓度之比为1∶3∶2
B.3v正(N2)=v逆(H2)
C.容器内压强保持不变
D.混合气体的相对分子质量保持不变
E.1mol N≡N键断裂,同时1mol H—H键断裂
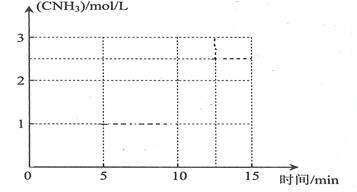
②若在恒温条件下,将N2与H2按一定比例混合通入一个容积为2L的密闭容器中,5min反应达平衡,n(N2)=1mol,n(H2)=1mol,n(NH3)=2mol,则反应速率v(N2)=________________,H2的平衡转化率=_________________;若保持容器的温度不变,在10min时将容器的容积压缩为lL,请在答题卡坐标图中,画出从反应开始至15min时c(NH3)随时间变化曲线示意图。
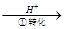 Cr2O72-
Cr2O72-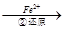 Cr3+
Cr3+ Cr(OH)3↓
Cr(OH)3↓  Cr2O72- (橙色)+H2O
Cr2O72- (橙色)+H2O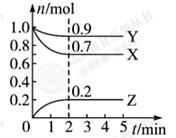
 与用物质Y表示的化学反应速率为0.1
与用物质Y表示的化学反应速率为0.1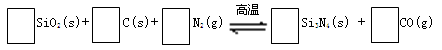

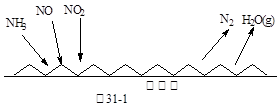
 H2SO3(l)
H2SO3(l)