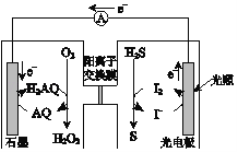
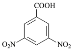
��Ŀ����
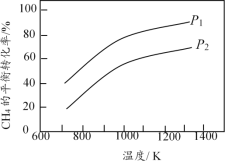
����Ŀ���������ݻ���ͬ�ĺ����ܱ������У���ʼʱ��������Ӧ�����������ʣ�����ͬ�¶��·�����ӦCH4(g)+ H2O(g) ![]() CO(g) + 3H2(g)(������������Ӧ)��CH4��ƽ��ת�������¶ȡ�ѹǿ�Ĺ�ϵ��ͼ��ʾ��
CO(g) + 3H2(g)(������������Ӧ)��CH4��ƽ��ת�������¶ȡ�ѹǿ�Ĺ�ϵ��ͼ��ʾ��
���� | ��ʼ���ʵ���/mol | CH4��ƽ�� ת���� | |||
CH4 | H2O | CO | H2 | ||
�� | 0.1 | 0.1 | 0 | 0 | 50% |
�� | 0.1 | 0.1 | 0.1 | 0.3 | / |
�� | 0 | 0.1 | 0.2 | 0.6 | / |
����˵����������
A. �÷�Ӧ��![]() H��0��ͼ��ѹǿP1>P2
H��0��ͼ��ѹǿP1>P2
B. ��ʼʱ����������v(CH4)����v(CH4)��
C. �ﵽƽ��ʱ����������CO�����ʵ������㣺n(CO)��< 2n(CO)��
D. �ﵽƽ��ʱ���������������������ѹǿ֮��P����P�� = 4��5
���𰸡�AD
��������
A������ͼ�������¶ȵ����ߣ�CH4��ת������������������ԭ��������Ӧ����Ϊ���ȷ�Ӧ������H>0������ͬ�¶��£�����ѹǿ���÷�Ӧƽ�����淴Ӧ������У�CH4��ת���ʽ��ͣ����P1<P2����A����
B�� CH4(g)+ H2O(g) ![]() CO(g) + 3H2(g)
CO(g) + 3H2(g)
��ʼ�� 0.1 0.1 0 0
�仯�� 0.05 0.05 0.05 0.15
ƽ�⣺ 0.05 0.05 0.05 0.15 �������������Ϊ1L�����ݻ�ѧƽ�ⳣ���Ķ��壬�÷�Ӧ�Ļ�ѧƽ�ⳣ��K=0.0675������II�е�Ũ����Ϊ0.33��0.1/(0.1��0.1)=0.27>0.0675��˵����Ӧ���淴Ӧ������У���v(CH4)����v(CH4)������B��ȷ��
C����II������ȫ��ת���ɷ�Ӧ�CH4��H2O�����ʵ�������0.2mol��II���Կ�����I�����ϣ���ͨ��0.1molCH4��0.1molH2O����ͨ��0.1molCH4��0.1molH2O���൱������ѹǿ������ƽ�ⲻ�ƶ�����ʱn��(CO)=2n(CO)I��������ѹǿ��ƽ�����淴Ӧ�����ƶ������n(CO)>n��(CO)����n(CO)��< 2n(CO)������C��ȷ��
D����II����ֵ��ȫ��ת����CO��H2O����III����ֵ��Ƚϣ�III��II��0.1molH2O������ѡ��B������II��III��Ӧ�����淴Ӧ������У���II������CO�����ʵ���Ϊxmol��III������CO�����ʵ���Ϊymol���ﵽƽ�����(0.6��2x)/(0.7��2y)=4/5��10x��8y=0.2����x=y=0.1ʱ��II���������������ʵ���Ϊ0.4mol��III���������������ʵ���Ϊ0.5mol��Ҳ����CO��H2Oȫ��ת����CH4��H2Oʱ���Ż����ѹǿ֮�ȵ���4��5�����÷�ӦΪ���淴Ӧ��������ȫ��ת������D����

 ����ѧУ�ֲ����ܲ�ϵ�д�
����ѧУ�ֲ����ܲ�ϵ�д� �ƸԺ���ȫ�����Ų��Ծ�ϵ�д�
�ƸԺ���ȫ�����Ų��Ծ�ϵ�д�