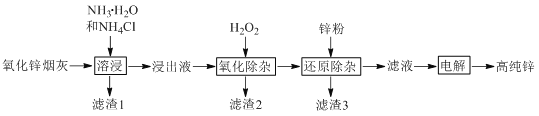
题目内容
【题目】一定温度下,三种碳酸盐MCO3(M:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲线如图所示。下列说法错误的是
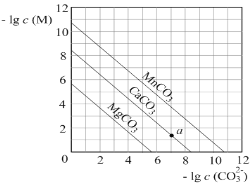
A. Ksp(MnCO3)的数量级为10-11
B. MgCO3的悬浊液中加入少量水充分振荡,c(Mg2+)不变
C. a点表示的溶液中,c(Ca2+)>c(CO32-)
D. 向浓度均为0.01mol·L-1的Mg2+、Ca2+、Mn2+混合溶液中逐滴加入Na2CO3溶液,最先形成MgCO3沉淀
【答案】D
【解析】
A.计算出Ksp(MnCO3)=c(Mn2+)c(CO32-)解答;
B.MgCO3的悬浊液中加入少量水,Ksp保持不变;
C.a点表示CaCO3的饱和溶液,但-lgc(CO32-)>-lgc(Ca2+);
D.Ksp越小,越易生成沉淀。
A.利用(0,10.7)或(10.7,0)计算Ksp(MnCO3)=c(Mn2+)c(CO32-)=1×10-10.7=100.3×10-11,1<100.3<10,所以Ksp(MnCO3)数量级为10-11,A正确;
B.MgCO3的悬浊液中加入少量水,温度不变,所以Ksp保持不变,所以c(Mg2+)不变,B正确;
C.a点表示CaCO3的饱和溶液,但-lgc(CO32-)>-lgc(Ca2+);所以c(Ca2+)>c(CO32-),C正确;
D.-lgc(CO32-)=4时,-lgc(Mn2+)最大,-lgc(Mg2+)最小,即c(Mn2+)最小,c(Mg2+)最大,所以Ksp(MnCO3)最小,Ksp(MgCO3)最大,所以向浓度均为0.01mol/L的Mg2+、Ca2+、Mn2+混合溶液中逐滴加入Na2CO3溶液,先生成MnCO3沉淀,D错误;
故合理选项是D。

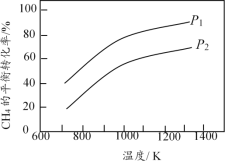
【题目】在三个容积相同的恒容密闭容器中,起始时按表中相应的量加入物质,在相同温度下发生反应CH4(g)+ H2O(g) ![]() CO(g) + 3H2(g)(不发生其他反应),CH4的平衡转化率与温度、压强的关系如图所示。
CO(g) + 3H2(g)(不发生其他反应),CH4的平衡转化率与温度、压强的关系如图所示。
容器 | 起始物质的量/mol | CH4的平衡 转化率 | |||
CH4 | H2O | CO | H2 | ||
Ⅰ | 0.1 | 0.1 | 0 | 0 | 50% |
Ⅱ | 0.1 | 0.1 | 0.1 | 0.3 | / |
Ⅲ | 0 | 0.1 | 0.2 | 0.6 | / |
下列说法错误的是
A. 该反应的![]() H>0,图中压强P1>P2
H>0,图中压强P1>P2
B. 起始时,容器Ⅱ中v(CH4)正<v(CH4)逆
C. 达到平衡时,容器Ⅰ、Ⅱ中CO的物质的量满足:n(CO)Ⅱ< 2n(CO)Ⅰ
D. 达到平衡时,容器Ⅱ、Ⅲ中气体的总压强之比PⅡ∶PⅢ = 4∶5