题目内容
【题目】某校化学兴趣小组用如图所示过程除去硫酸铝中含有的Mg2+、K+杂质离子并尽可能减少硫酸铝的损失。
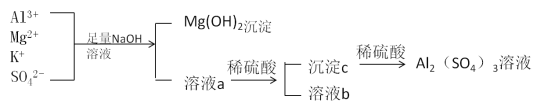
请回答下列问题:
(1)混合物中加入足量氢氧化钠溶液时,反应的离子方程式是________________、________________________________。
(2)能否用氨水代替氢氧化钠溶液____________,其原因是____________________________。
(3)溶液a中存在的离子有________________________,在溶液a中加入稀硫酸时需控制硫酸的量,其原因是__________________________________________,改进方法是__________________________________________________________。
【答案】Mg2++2OH-===Mg(OH)2↓ Al3++4OH-==AlO2-+2H2O(或Al3++3OH-==Al(OH)3↓、Al(OH)3+OH-=== AlO2-+2H2O) 不能 因为在Al3+与氨水反应生成Al(OH)3后,Al(OH)3不能与氨水继续反应,从而不能将Al(OH)3与Mg(OH)2分开 SO42-、K+、AlO2-、OH-、Na+ 因为Al(OH)3能与强酸反应,所以在加入稀硫酸时,需要控制硫酸的量 向溶液a中通入过量的二氧化碳气体。
【解析】
原硫酸铝溶液中加入足量的NaOH溶液时发生的反应有Al2(SO4)3+8NaOH=2NaAlO2+4H2O+3Na2SO4,MgSO4+2NaOH=Mg(OH)2↓+Na2SO4,所以溶液a中主要成分是NaAlO2、K2SO4、Na2SO4、NaOH。向溶液a中加稀硫酸时先是中和反应,再有Al(OH)3沉淀生成2NaAlO2+H2SO4+2H2O=2Al(OH)3↓+Na2SO4,但要控制加入的稀硫酸的用量,因为Al(OH)3能溶解于硫酸。沉淀c是Al(OH)3,再与稀硫酸反应生成Al2(SO4)3。由此分析。
(1)原硫酸铝溶液中加入足量氢氧化钠溶液时发生反应的化学方程式为:Al2(SO4)3+8NaOH=2NaAlO2+4H2O+3Na2SO4,MgSO4+2NaOH=Mg(OH)2↓+Na2SO4,再根据离子方程式书写原则,将化学方程式改写成离子方程式为:Al3++4OH-=AlO2-+2H2O [ 或Al3++3OH-=Al(OH)3↓、Al(OH)3+OH-=AlO2-+2H2O ],Mg2++2OH-=Mg(OH)2↓。
(2)Al3++3NH3·H2O=Al(OH)3↓+3NH4+,Al(OH)3不能溶解于氨水。不能用氨水代替氢氧化钠溶液,是因为在Al3+与氨水反应生成Al(OH)3后,Al(OH)3不能与氨水继续反应,从而不能将Al(OH)3与Mg(OH)2分开。
(3)原Al2(SO4)3溶液中加入足量的NaOH溶液时发生的反应有:Al2(SO4)3+8NaOH=2NaAlO2+4H2O+3Na2SO4,MgSO4+2NaOH=Mg(OH)2↓+Na2SO4,因此溶液a中主要成分是NaAlO2、Na2SO4、K2SO4、NaOH,所以溶液a中存在的离子有AlO2-、SO42-、K+、OH-、Na+。Al(OH)3+3H+=Al3++3H2O,因为Al(OH)3能与强酸反应,所以在加入稀硫酸时,需要控制硫酸的量。因为Al(OH)3不会溶解于H2CO3等弱酸,可利用H2CO3制取Al(OH)3:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,能防止部分Al(OH)3转化成Al3+,所以改进的方法是向溶液a中通入过量的二氧化碳气体。

 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案【题目】已知:N2(g)+3H2(g)![]() 2NH3(g)ΔH=-92.4kJ/mol起始反应物为N2和H2物质的量之比为1:3,且总物质的量不变,在不同压强和濫度下,反应达到平衡时体系中NH3的物质的量分数如下表:
2NH3(g)ΔH=-92.4kJ/mol起始反应物为N2和H2物质的量之比为1:3,且总物质的量不变,在不同压强和濫度下,反应达到平衡时体系中NH3的物质的量分数如下表:
温度 物质的量分数 压强 | 400℃ | 450℃ | 500℃ | 600℃ |
20MPa | 0.387 | 0.274 | 0.189 | 0.088 |
30MPa | 0.478 | 0.359 | 0.260 | 0.129 |
下列说法正确的是
A. 体系中NH3的物质的量分数越大,则正反应速率越大
B. 反应达到平衡时,N2和H2的转化率之比均为1
C. 反应达到平衡时,放出的热量均为92.4kJ
D. 600℃,30MPa下反应达到平衡时,生成NH3的物质的量最多