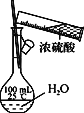
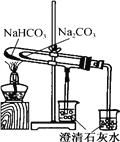
题目内容
【题目】若在加入铝粉能放出H2的溶液中,分别加入下列各组离子,肯定不能共存的
A. Fe3+、Mg2+、Cl-、Na+
B. Ba2+、Mg2+、![]() 、Ca2+
、Ca2+
C. ![]() 、Na+、K+、
、Na+、K+、![]()
D. ![]() 、K+、Al3+、H+
、K+、Al3+、H+
【答案】B
【解析】
Al既能与酸发生反应放出H2,也能与强碱在溶液中发生反应放出H2,从溶液显酸性、碱性两种情况分析判断。
A.在碱性条件下,Fe3+、Mg2+能与OH-发生沉淀反应,不能大量共存,A不符合题意;
B.在酸性条件下,H+与HCO会发生反应,不能大量共存;在碱性条件下, OH-与Ba2+、Mg2+、HCO、Ca2+会发生反应,形成沉淀,也不能大量共存,因此B符合题意;
C.在酸性条件下,H+与CO![]() 会发生反应,不能大量共存,,C不符合题意;
会发生反应,不能大量共存,,C不符合题意;
D.在碱性条件下,Al3+、H+与OH-反应,不能大量共存,D不符合题意;
故本题合理选项是B。

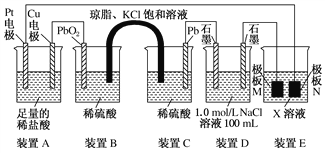
【题目】某学习小组通过下列装置探究 MnO2与FeCl3·6H2O能否反应产生Cl2。
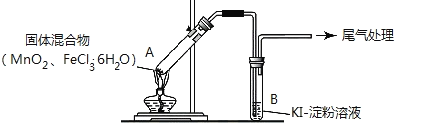
实验操作和现象如下表:
实验编号 | 操作 | 现象 |
实验 1 | 按上图所示加热MnO2与FeCl3·6H2O混合物 | ①试管A中部分固体溶解,上方出现白雾 ②稍后,产生黄色气体,管壁附着黄色液滴 ③试管B中溶液变蓝 |
实验 2 | 把A中的混合物换为FeCl3·6H2O,B中溶液换为KSCN溶液,加热。 | A中部分固体溶解,产生白雾和黄色气体,B中KSCN溶液变红 |
回答下列问题:
(1)实验1和实验2产生白雾的原因是___________________________。
(2)实验2说明黄色气体中含有___________(填化学式)则实验1中③的现象也可能是发生了另一个离子反应,则其离子方程式为______________________________。
(3)为进一步确认黄色气体中含有Cl2,该学习小组对实验1提出两种改进方案:
方案1:在A、B 间增加盛有某种试剂的洗气瓶C,结果B中溶液仍变为蓝色。
方案2:将B中淀粉KI溶液替换为NaBr溶液,结果B中溶液呈橙红色,且未检出Fe2+。
则方案1中C中盛放的试剂是_________________;方案2中检验 Fe2+的试剂名称是____________,选择NaBr溶液的依据是__________________。
(4)实验1充分加热后,若反应中被氧化与未被氧化的氯元素质量之比为1:2,则A中发生反应的化学方程式为____________________________。
(5)该学习小组认为实验1中溶液变蓝,可能还有另外一种原因是__________。请你设计实验方案验证此猜想__________________________。