题目内容
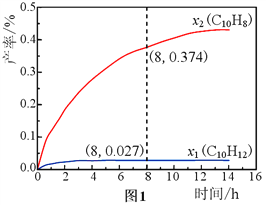
【题目】常温下,向10mL1 molL-1HCl溶液中滴加1 molL-1CH3COONa溶液,所得混合液的pH 与加入CH3COONa溶液的体积(V)的变化如图所示。下列说祛错误的是
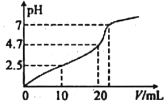
A. 常温下,CH3COOH 的电离常数Ka≈2.0×10-5
B. 随着V的增加,混合液中水的电离程度在不断增加
C. 当V=20 mL时,混合液中c(Na+)>c(Cl-)>c(CH3COO-)>c(H+)>c(OH-)
D. 当混合液的pH=7时,混合液中c(Cl-)=c(CH3COOH)
【答案】C
【解析】向10mL1 molL-1HCl溶液中滴加10mL 1 molL-1CH3COONa溶液,溶液变为0.5molL-1CH3COOH 和NaCl,此时PH=2.5,常温下,CH3COOH的电离常数Ka≈![]() 2.0×10-5,故A正确;醋酸根离子水解促进水电离,醋酸钠浓度越大,水电离程度越大,故B正确;当V=20mL时,溶液中含有等浓度的CH3COOH、NaCl、CH3COONa,溶液呈酸性,说明醋酸电离大于醋酸钠水解,所以混合液中c(Na+)>c(CH3COO-)>c(Cl-)>c(H+)>c(OH-),故C错误;当混合液的pH=7时,说明醋酸的电离与醋酸钠水解相互抵消,所以混合液中c(Cl-)=c(CH3COOH),故D正确。
2.0×10-5,故A正确;醋酸根离子水解促进水电离,醋酸钠浓度越大,水电离程度越大,故B正确;当V=20mL时,溶液中含有等浓度的CH3COOH、NaCl、CH3COONa,溶液呈酸性,说明醋酸电离大于醋酸钠水解,所以混合液中c(Na+)>c(CH3COO-)>c(Cl-)>c(H+)>c(OH-),故C错误;当混合液的pH=7时,说明醋酸的电离与醋酸钠水解相互抵消,所以混合液中c(Cl-)=c(CH3COOH),故D正确。

练习册系列答案
相关题目