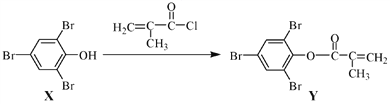
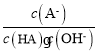题目内容
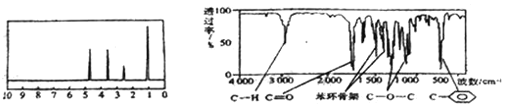
【题目】化合物A经李比希法和质谱法分析得知其分子式为C8H8O2,相对分子质量为136,A的核磁共振氢谱有4个峰且面积之比为1:2:2:3,A分子中只含一个苯环,且苯环上只有一个取代基,其核磁共振氢谱与红外光谱如图。关于A的下列说法中不正确的是( )
A.A分子属于酯类化合物,在一定条件下能发生水解反应
B.A在一定条件下可与3molH2发生加成反应
C.符合题中A分子结构特征的有机物只有一种
D.与A属于同类化合物的同分异构体只有2种
【答案】D
【解析】
有机物A的分子式为分子式C8H8O2,不饱和度为![]() =5,A分子中只含一个苯环且苯环上只有一个取代基,A的核磁共振氢谱有4个峰且面积之比为1:2:2:3,说明A含有四种氢原子且其原子个数之比为1:2:2:3,结合红外光谱可知,分子中存在酯基等基团,故有机物A的结构简式为
=5,A分子中只含一个苯环且苯环上只有一个取代基,A的核磁共振氢谱有4个峰且面积之比为1:2:2:3,说明A含有四种氢原子且其原子个数之比为1:2:2:3,结合红外光谱可知,分子中存在酯基等基团,故有机物A的结构简式为![]() ,
,
A.含有酯基,可发生水解反应,故A正确;
B.只有苯环能与氢气反应,则A在一定条件下可与3 mol H2发生加成反应,故B正确;
C.有机物A的结构简式为![]() ,只有一种,故C正确;
,只有一种,故C正确;
D.属于同类化合物,应含有酯基、苯环,若为羧酸与醇形成的酯有:甲酸苯甲酯,若为羧酸与酚形成的酯,可以是乙酸酚酯,可以是甲酸与酚形成的酯,甲基有邻、间、对三种位置,故5种异构体,故D错误;
故选D。

 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案【题目】已知25℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | Ka=1.8×10﹣5 | Ka1=4.3×10﹣7 Ka2=5.6×10﹣11 | Ka=3.0×10﹣8 |
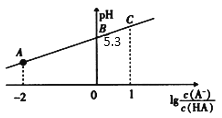
(1)物质的量浓度均为0.1molL﹣1的四种溶液:pH由小到大排列的顺序是_______(用编号填写)
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
(2)常温下,0.1molL﹣1 CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是_____(填字母)_______
A. c(H+) B.![]() C. c(H+)c(OH﹣) D.
C. c(H+)c(OH﹣) D. ![]() E.
E. ![]()
(3)写出向次氯酸钠溶液中通入少量二氧化碳的离子方程式:__________________
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中
c(CH3COO﹣)﹣c(Na+)=________(填准确数值)。
(5)25℃时,将a molL﹣1的醋酸与b molL﹣1氢氧化钠等体积混合,反应后溶液恰好显中性,用a、b表示醋酸的电离平衡常数为____________________________________
(6)标准状况下,将1.12L CO2通入100mL 1molL﹣1的NaOH溶液中,用溶液中微粒的浓度符号完成下列等式: c(OH﹣)=2c(H2CO3)+_________________________
【题目】下表是几种常用燃料(1mol)完全燃烧时放出的热量:
物质 | 炭粉(C) | 一氧化碳(CO) | 氢气(H2) | 甲烷(CH4) | 乙醇(C2H5OH) |
状态 | 固体 | 气体 | 气体 | 气体 | 液体 |
热量(kJ) | 392.8 | 282.6 | 285.8 | 890.3 | 1367 |
(1)从热量角度分析,目前最适合家庭使用的优质气体燃料是___。
(2)写出管道煤气中的一氧化碳燃烧的热化学方程式___。
(3)充分燃烧1mol表中各种燃料,排放出二氧化碳的量最多的是___。
(4)矿物燃料储量有限,而且在燃烧过程中会产生污染。根据能源多样化的发展战略,我国开发利用的绿色能源有氢能、___等。