题目内容
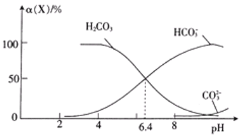
【题目】25℃时,在20mL0.1mol·L-1一元弱酸HA溶液中滴加0.1mol·L-1NaOH溶液,溶液中1g![]() 与pH关系如图所示。下列说法不正确的是
与pH关系如图所示。下列说法不正确的是
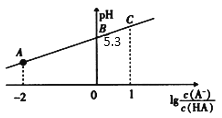
A.A点对应溶液中:c(A-)>c(Na+)>c(H+)>c(OH-)
B.25℃时,HA酸的电离常数的数量级为 10-6
C.对C点溶液加水稀释,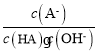 一定减小
一定减小
D.当加入NaOH溶液体积为10 mL时,水的电离受到了抑制
【答案】C
【解析】
A.据图可知A点对应溶液的pH<7,显酸性,则c(H+)>c(OH-),结合电荷守恒c(Na+)+c(H+)=c(A-)+c(OH-)可知:c(A-)>c(Na+)>c(H+)>c(OH-),故A正确;
B.据图可知B点1g![]() =0,即
=0,即![]() =1,pH=5.3,即c(H+)=10-5.3mol/L,所以HA的电离平衡常数Ka=
=1,pH=5.3,即c(H+)=10-5.3mol/L,所以HA的电离平衡常数Ka=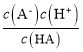 =10-5.3,数量级为 10-6,故B正确;
=10-5.3,数量级为 10-6,故B正确;
C.A-的水解平衡常数表达式为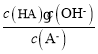 ,加水稀释水解平衡常数不变,则
,加水稀释水解平衡常数不变,则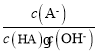 不变,故C错误;
不变,故C错误;
D.加入NaOH溶液体积为10mL时,溶液中的溶质为等物质的量浓度的NaA和HA,HA的电离平衡常数为Ka=10-5.3,则其水解平衡常数Kh=![]() =10-8.7< Ka,所以此时溶液中的HA的电离程度大于A-的水解程度,酸的电离抑制水的电离,则此时水的电离受到抑制,故D正确;
=10-8.7< Ka,所以此时溶液中的HA的电离程度大于A-的水解程度,酸的电离抑制水的电离,则此时水的电离受到抑制,故D正确;
故答案为C。

【题目】亚硝酰氯(NOCl,熔点:-64.5℃,沸点:-5.5℃)是一种黄色气体,遇水易反应,生成一种氯化物和两种常见的氮氧化物,其中一种呈红棕色。可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温常压下合成。
(1)甲组的同学拟制备原料气NO和Cl2,制备装置如图所示:
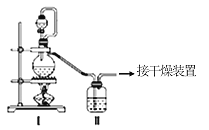
为制备纯净干燥的气体,下表中缺少的药品是:
制备原料 | 装置Ⅰ | 装置Ⅱ | |
烧瓶中 | 分液漏斗中 | ||
制备纯净Cl2 | MnO2 | ①________ | 饱和食盐水 |
制备纯净NO | Cu | 稀硝酸 | ②________ |
(2)乙组同学利用甲组制得的NO和Cl2制备NOCl,装置如图所示:
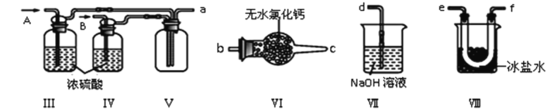
①装置连接顺序为a→_______(按气流自左向右方向,用小写字母表示)。
②为了使实验顺利进行,实验中先通入的气体是_____(填Cl2或NO),待装置Ⅴ中充满气体时,再将另一气体缓缓通入,此操作的目的是_____。
③装置Ⅴ生成NOCl的化学方程式是_____。
④装置Ⅵ的作用为_____,若无该装置,Ⅷ中NOCl可能发生反应的化学方程式为_______。
(3)丁组同学用以下方法测定亚硝酰氯(NOCl)纯度:取Ⅷ中所得液体m克溶于水,配制成250mL溶液,取出25.00mL,以K2CrO4溶液为指示剂,用c mol/LAgNO3 标准溶液滴定至终点,消耗标准溶液的体积为b mL。亚硝酰氯(NOCl)的质量分数为_________(用代数式表示即可)。