题目内容
【题目】A、B、C、D为原子序数依次增大的四种元素,A2-和B+具有相同的电子构型: C、D为同周期元素,C核外电子总数是最外层层电子数的3倍;D元素最外层有一个未成对电子。回答下列问题:
(1)四种元素中电负性最大的是___________(填元素符号),其中C原子的核外电子排布式为__________。
(2)单质A有两种同素异形体,其中沸点高的是____________(填分子式);A和B的氢化物所属的晶体类型分别为___________和___________。
(3)C和D反应可生成组成比为1:3的化合物E,E的立体构型为____________,中心原子的杂化轨道类型为________________。
(4)单质D与湿润的Na2CO3反应可制备D2A,其化学方程式为______________。
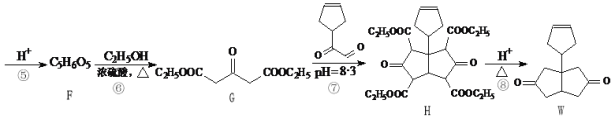
(5)A和B能够形成化合物F,其晶胞结构如图所示,晶胞参数a=0.566nm,F的化学式为________;晶胞中A原子的配位数为____________;列式计算晶体F的密度(g cm-3 )__________。
【答案】O ls22s22p63s23p3(或[Ne]3s23p3) O3 分子晶体 离子晶体 三角锥形 sp3 2Cl2+2Na2CO3+H2O=Cl2O+2NaHCO3+2NaCl(或2Cl2+Na2CO3=Cl2O+CO2+2NaCl) Na2O 8 2.27 g/cm3
【解析】
A、B、C、D为原子序数依次增大的四种元索,C核外电子总数是最外层电子数的3倍,则C为P元素,C、D为同周期元索,D元素最外层有一个未成对电子,则D为Cl元素,A2-和B+具有相同的电子构型,则A为O、B为Na元素;通过以上分析,A、B、C、D分别是O、Na、P、Cl元素。
(1)元素的非金属性越强,其电负性越大,这几种元素非金属性最强的是O元素,则电负性最大的是O元素;C是P元素,其原子核外有15个电子,根据构造原理书写P原子核外电子排布式为ls22s22p63s23p3(或[Ne]3s23p3);故答案为:O;ls22s22p63s23p3(或[Ne]3s23p3);
(2)单质A为氧气,氧气的同素异形体是臭氧,二者都是分子晶体,分子晶体熔沸点与范德华力成正比,范德华力与相对分子质量成正比,臭氧的相对分子质量大于氧气,则范德华力:臭氧>氧气,所以熔沸点较高的是O3;A和B的氢化物所属的晶体类型分别为水是分子晶体和NaH为离子晶体。故答案为:O3;分子晶体;离子晶体;
(3)C和D反应可生成组成比为1:3的化合物PCl3,PCl3中P原子价层电子对个数=3+![]() =4且含1个孤电子对,根据价层电子对互斥理论判断该分子的立体构型为三角锥形、中心原子的杂化轨道类型为sp3,故答案为:三角锥形;sp3;
=4且含1个孤电子对,根据价层电子对互斥理论判断该分子的立体构型为三角锥形、中心原子的杂化轨道类型为sp3,故答案为:三角锥形;sp3;
(4)单质Cl2与湿润的Na2CO3反应可制备Cl2O,其化学方程式为2Cl2+2Na2CO3+H2O= Cl2O+2NaHCO3+2NaCl (或2Cl2+Na2CO3=Cl2O+CO2+2NaCl)。故答案为:2Cl2+2Na2CO3+H2O= Cl2O+2NaHCO3+2NaCl (或2Cl2+Na2CO3=Cl2O+CO2+2NaCl);
(5)O和Na能够形成化合物F,半径大的为O元素离子、半径小的为Na+,该晶胞中大球个数=8×![]() +6×
+6×![]() =4、小球个数为8,则大球、小球个数之比=4:8=1:2,则化学式为Na2O;观察晶胞中面心的原子,与之相连的原子有8个,晶胞中O原子的配位数为8;该晶胞体积=a3nm3,晶胞密度=
=4、小球个数为8,则大球、小球个数之比=4:8=1:2,则化学式为Na2O;观察晶胞中面心的原子,与之相连的原子有8个,晶胞中O原子的配位数为8;该晶胞体积=a3nm3,晶胞密度= =
=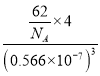 g·cm-3=2.27g·cm-3;故答案为:Na2O;2.27g·cm-3。
g·cm-3=2.27g·cm-3;故答案为:Na2O;2.27g·cm-3。

【题目】化学反应速率和限度与生产、生活密切相关。
(1)某学生为了探究锌与盐酸反应过程中的速率变化,在400mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如表(累计值):
时间(min) | 1 | 2 | 3 | 4 | 5 |
氢气体积(mL)(标准状况) | 100 | 240 | 464 | 576 | 620 |
①哪一时间段反应速率最大___min(填0~1、1~2、2~3、3~4、4~5),原因是____。
②求3~4分钟时间段以盐酸的浓度变化来表示的该反应速率___(设溶液体积不变)。
(2)另一学生为控制反应速率防止反应过快难以测量氢气体积,他事先在盐酸中加入等体积的下列溶液以减慢反应速率,你认为不可行的是(________)
A.蒸馏水
B.KCl溶液
C.KNO3溶液
D.CuSO4溶液
(3)某温度下在4L密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化曲线如图。
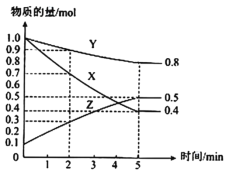
①该反应的化学方程式是___。
②该反应达到平衡状态的标志是___。
A.X、Y、Z的反应速率相等
B.X、Y的反应速率比为3:1
C.容器内气体压强保持不变
D.生成1molY的同时生成2molZ
③2min内X的转化率为___。