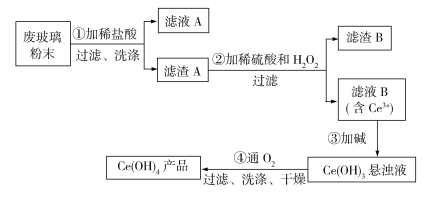
题目内容
【题目】X、Y、Z三种主族元素的单质在常温下都是常见的无色气体,在适当条件下,三者之间可以两两发生反应生成分别是双核、三核和四核的甲、乙、丙三种分子,且乙、丙分子中含有X元素的原子个数比为2∶3。请回答下列问题:
(1)元素Y在周期表中的位置是___,丙分子的电子式为____。
(2)若甲与Y单质在常温下混合就有明显红棕色气体的现象,则甲的化学式为___。丙在一定条件下转化为甲和乙的反应方程式为___。
(3)化合物丁含X、Y、Z三种元素,丁是一种常见的强酸,将丁与丙按物质的量之比1∶1混合后所得物质戊的晶体结构中含有的化学键为___(选填序号)。
a.只含共价键 b.只含离子键 c.既含离子键,又含共价键
写出戊与烧碱的浓溶液加热时反应的离子方程式___。
(4)在标准状况下,用装满丙气体的烧瓶做喷泉实验,喷泉结束后水充满烧瓶,假设烧瓶中溶质不能扩散出来,则所得溶液的物质的量浓度为____。(保留两位有效数字)
(5)X与Y两种元素之间可形成一种18e-微粒的分子,此分子是医疗上常用的消毒剂,请写出此分子的结构式___。
【答案】第二周期VIA 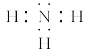 NO 4NH3+5O2
NO 4NH3+5O2![]() 4NO+6H2O c NH
4NO+6H2O c NH![]() +OH-
+OH-![]() NH3↑+H2O
NH3↑+H2O ![]() mol·L-1,约为0.045mol·L-1 H-O-O-H
mol·L-1,约为0.045mol·L-1 H-O-O-H
【解析】
略

 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案【题目】某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。
为了进一步研究硫酸铜的用量对氢气生成速率的影响,该同学设计了如下一系列实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。(假设混合溶液总体积等于混合前各溶液的体积之和)
实验 混合溶液 | A | B | C | D | E | F |
4mol/LH2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
请回答下列问题:
①请完成此实验设计,其中:V3=___,V8=___;
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高。但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因___。
③实验A测得:收集到产生H2体积为112mL(标准状况下)时所需的时间为10分钟,求化学反应速率υ(H2SO4)=___(忽略反应前后溶液体积变化)。