题目内容
1.尿素可作为H2O2的稳定载体,生产一种固态、耐储存、易运输的新型氧化剂和消毒剂-过氧化尿素[CO(NH2)2•H2O2],其合成工艺流程如图一所示:
请回答下列问题:
(1)操作I、II的名称分别是低温蒸发、过滤.CO(NH2)2•H2O2分子中尿素和过氧化氢之间以氢键结合,其结合力较弱,具有尿素和过氧化氢双重性质.
(2)工业上生产尿素所需的原料气可由天然气与水反应制备,已知:
①甲烷、氢气的燃烧热分别为890.3kJ/mol、285.8kJ/mol
②H2O(l)=H2O(g)△H=+44.0kJ/mol
写出CH4与水蒸气作用生产CO2和H2的热化学方程式:CH4(g)+2H2O(g)═CO2(g)+4H2(g)△H=+164.9 kJ/mol.
(3)为测定产品中H2O2的含量,称取干燥样品12.0g配成250mL溶液,取25.00mL
于锥形瓶中,加入适量硫酸酸化,用0.20mol/LKMnO4标准溶液滴定,三次滴定平均消耗KMnO4溶液20.00mL.(KMnO4溶液与尿素不反应).
①完成并配平方程式:

②计算出产品中H2O2的质量分数为28.3%.
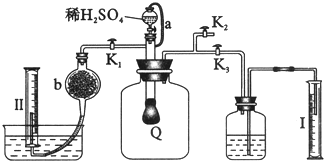
(4)电解含尿素的废水既可以处理废水,又可制得纯氢,电解原理如图二所示.电解池中隔膜仅阻止气体通过,A、B两极均为惰性电极.B极连接电源的负极(填“正”或“负”),阳极电极反应方程为CO(NH2)2-6e-+8OH-=N2↑+CO32-+6H2O.
分析 (1)因为过氧化尿素具有尿素和过氧化氢双重性质,受热易分解,所以应使溶液在较低温度下蒸发,因此操作I、II的名称分别是低温蒸发、过滤;CO(NH2)2•H2O2分子中尿素和过氧化氢都已经达到稳定结构,二者之间的结合力较弱,应该为氢键;
(2)首先写出CH4与H2O反应的化学方程式并注明状态,然后根据盖斯定律求焓变,可得热化学方程式.
(3)①根据氧化还原反应中,化合价升高的价数和降低相等,MnO4?中Mn元素降低5价,H2O2中O元素升高1价,所以MnO4?和Mn2+的系数为2,H2O2和O2的系数为5,然后利用观察法配平化学方程式.
②根据反应时KMnO4与H2O2的物质的量之比为2:5,可得产品中H2O2的质量分数=0.2mol/L×0.02L×5/2×10×34g/mol÷12g×100%=28.3%
(4)根据图示,B极发生H+得电子生成H2,所以B为阴极,连接电源的负极;阳极CO(NH2)2失去电子转化为N2,因为电解液含KOH,所以电极方程式为:CO(NH2)2-6e-+8OH-═N2↑+CO32-+6H2O
解答 解:(1)因为过氧化尿素具有尿素和过氧化氢双重性质,受热易分解,所以应使溶液在较低温度下蒸发,因此操作I、II的名称分别是低温蒸发、过滤;CO(NH2)2•H2O2分子中尿素和过氧化氢都已经达到稳定结构,二者之间的结合力较弱,应该为氢键;
故答案为:低温蒸发;过滤;氢键;
(2)首先写出CH4与H2O反应的化学方程式并注明状态,然后根据盖斯定律求焓变,△H=-890.3kJ•mol?1+4×285.8kJ•mol?1-2×44kJ•mol?1 =+164.9 kJ•mol?1,可得热化学方程式为:CH4(g)+2H2O(g)═CO2(g)+4H2(g)△H=+164.9 kJ/mol;
故答案为:CH4(g)+2H2O(g)═CO2(g)+4H2(g)△H=+164.9 kJ/mol;
(3)①根据氧化还原反应中,化合价升高的价数和降低相等,MnO4?中Mn元素降低5价,H2O2中O元素升高1价,所以MnO4?和Mn2+的系数为2,H2O2和O2的系数为5,然后利用观察法配平化学方程式为:2MnO4-+5H2O2+6H+═2Mn2++5O2↑+8H2O;
故答案为:2MnO4-+5H2O2+6H+═2Mn2++5O2↑+8H2O;
②根据2MnO4-+5H2O2+6H+═2Mn2++5O2↑+8H2O,反应时KMnO4与H2O2的物质的量之比为2:5,可得产品中H2O2的质量分数=0.2mol/L×0.02L×$\frac{5}{2}$×10×34g/mol÷12g×100%=28.3%;
故答案为:28.3%;
(4)根据图示,B极发生H+得电子生成H2,所以B为阴极,连接电源的负极;阳极CO(NH2)2失去电子转化为N2,因为电解液含KOH,所以电极方程式为:CO(NH2)2-6e-+8OH-═N2↑+CO32-+6H2O;
故答案为:负;CO(NH2)2-6e-+8OH-=N2↑+CO32-+6H2O.
点评 本题考查了物质分离方法,化学方程式计算,有机物质结构分析判断,离子方程式书写,实验 过程分析和电解池原理的理解应用是解题关键,题目难度中等.

 名校课堂系列答案
名校课堂系列答案
| A. | 该反应为吸热反应 | |
| B. | CO(g)和H2O(g)具有的总能量大于CO2(g)和H2(g)具有的总能量 | |
| C. | 该反应不需要加热就能进行 | |
| D. | 1 mol CO2(g)和1 mol H2(g)反应生成1 mol CO(g)和1 mol H2O(g)要放出41 kJ热量 |
| A. | 1 | B. | 12 | C. | 16 | D. | 23 |
| A. | 20℃0.1mol•L-1的盐酸溶液20 mL与0.5g块状碳酸钙反应 | |
| B. | 20℃0.2mol•L-1的盐酸溶液10mL与0.5g粉状碳酸钙反应 | |
| C. | 10℃0.2mol•L-1的盐酸溶液10mL与0.5g粉状碳酸钙反应 | |
| D. | 10℃0.1mol•L-1的盐酸溶液20 mL与1g块状碳酸钙反应 |
| A. | CuCl2 | B. | ZnCl2 | C. | FeCl3 | D. | AlCl3 |
 (1)合成氨工业对国民经济和社会发展具有重要的 意义.某合成氨工业中氢气由天然气和水反应制备,其主要反应为:CH4(g)+2H2O (g)?CO2(g)+4H2(g)反应过程中能量变化如图所示,则该反应为吸热反应(填“吸热”或“放热”)
(1)合成氨工业对国民经济和社会发展具有重要的 意义.某合成氨工业中氢气由天然气和水反应制备,其主要反应为:CH4(g)+2H2O (g)?CO2(g)+4H2(g)反应过程中能量变化如图所示,则该反应为吸热反应(填“吸热”或“放热”) Ⅰ.已知一个碳原子上连有两个羟基时,易发生下列转化.
Ⅰ.已知一个碳原子上连有两个羟基时,易发生下列转化.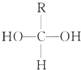 $\stackrel{-H_{2}O}{→}$
$\stackrel{-H_{2}O}{→}$
 或
或