题目内容
铁是地壳中含量第二的金属元素,其单质、合金及化合物在生产生活中的应用广泛。
(―)工业废水中含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大的危害,必须进行处理。常用的处理方法是电解法,该法用Fe作电极电解含Cr2O72-的酸性废水,随着电解的进行,阴极附近溶液pH升高,产生Cr(OH)3沉淀。
(1)用Fe作电极的目的是 。
(2)阴极附近溶液pH升高的原因是_ (用电极反应式解释);溶液中同时生成的沉淀还有 。
(二)氮化铁磁粉是一种磁记录材料,利用氨气在400℃以上分解得到的氮原子渗透到高纯铁粉中可制备氮化铁。制备高纯铁粉涉及的主要生产流程如下: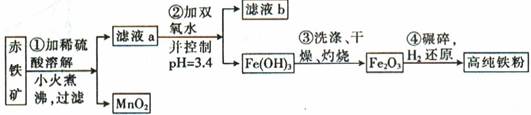
已知①某赤铁矿石含60.0%Fe2O3、3.6%FeO,还含有Al2O3、MnO2、CuO等。
②部分阳离子以氢氧化物形式完全沉淀时溶液的pH如下:
(3)步骤②中加双氧水的目的是 ,pH控制在3.4的作用是 ,已知25℃时,Ksp[Cu(OH)2] =2.0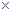 10-20,该温度下反应:Cu2++2H2O
10-20,该温度下反应:Cu2++2H2O Cu(OH)2+2H+的平衡常数K= 。
Cu(OH)2+2H+的平衡常数K= 。
(4)如何判断步骤③中沉淀是否洗涤干净? 。
(5)制备氮化铁磁粉的反应:Fe+NH3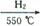 FexNy+H2 (未配平),若整个过程中消耗氨气34.0g,消耗赤铁矿石2kg,设整个过程中无损耗,则FexNy磁粉的化学式为 。
FexNy+H2 (未配平),若整个过程中消耗氨气34.0g,消耗赤铁矿石2kg,设整个过程中无损耗,则FexNy磁粉的化学式为 。
(1)提供还原剂Fe2+
(2)2H++2e-=H2↑(或2H2O-2e-=H2+2OH-);Fe(OH)3
(3)将溶液中的Fe2+氧化为Fe3+;使溶液中的Fe3+完全沉淀,而其他金属离子不沉淀;5.0×10-9
(4)取少量最后一次洗涤液于试管中,滴加BaCl2溶液,若有白色沉淀生成,则表明沉淀没有洗净;若无沉淀生成,则表明已洗净。
(5)Fe8N
解析试题分析:(1)根据题意,Cr2O72-和CrO42-被还原为Cr3+,因此需要还原剂,而Fe作电极电解时产生的Fe2+具有还原性,Fe2+被氧化为Fe3+。
(2)电解时,阴极H+放电产生H2,剩余OH-,溶液显碱性。溶液中的金属离子除了Cr3+,还有Fe3+,因此还会生成Fe(OH)3。
(3)根据流程图,沉淀只有Fe(OH)3,为使铁离子完全沉淀,需将Fe2+转化为Fe3+,加双氧水是为了将Fe2+氧化为Fe3+。根据金属离子沉淀时的pH,可知控制pH=3.4,是为了使铁完全沉淀,而其他离子不沉淀,得到纯净的铁的化合物。反应平衡常数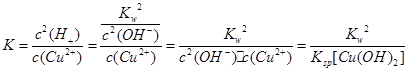 ,代入数据可得K=5.0×10-9。
,代入数据可得K=5.0×10-9。
(4)流程中第一步用硫酸溶解固体,故检验沉淀是否洗净,可检验沉淀中是否含有SO42-。
(5)2kg矿石中的含铁量为: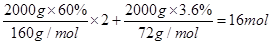 ,氨气的物质的量为
,氨气的物质的量为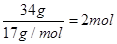 ,即反应中n(Fe):n(NH3)=8:1,因此反应的化学方程式为16Fe+2NH3
,即反应中n(Fe):n(NH3)=8:1,因此反应的化学方程式为16Fe+2NH3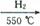 2Fe8N+3H2。
2Fe8N+3H2。
考点:考查氧化还原反应,沉淀溶解平衡,电解池,化学计算等。

 导学全程练创优训练系列答案
导学全程练创优训练系列答案常温下,将a mL 三种一元酸分别和NaOH溶液等体积混合,实验数据如下:
| 组别 | c(一元酸) | c(NaOH) /mol/L | 混合溶液的pH |
| 甲 | c(HX)=0.1 mol/L | 0.1 | pH = x |
| 乙 | c(HY)=0.1mol/L | 0.1 | pH = 7 |
| 丙 | c(HZ)=0.1 mol/L | 0.1 | pH = 9 |
(1)上述三种酸中一定属于强酸的是___________;
(2)丙组实验发生反应的离子方程式为 ,所得溶液中由水电离出的c(OH-) = mol/L;
(3)甲组中x的值_____7(填>、<、=);
(4)部分实验反应过程中的pH变化曲线如下图:
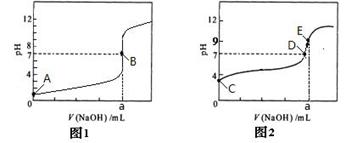
①表示乙组实验的pH变化曲线是________________
②上图中表示溶液呈中性的点为_________,表示溶液恰好完全反应的点是_______
③E点对应离子浓度由大到小的顺序为 。
工业碳酸钠(纯度约为98%)中含有Ca2+、Mg2+、Fe3+、Cl-和SO42—等杂质,提纯工艺线路如图所示: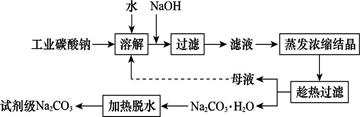
Ⅰ.碳酸钠的饱和溶液在不同温度下析出的溶质如图所示:
Ⅱ.有关物质的溶度积如下
| 物质 | CaCO3 | MgCO3 | Ca(0H)2 | Mg(OH)2 | Fe(OH)3 |
| Ksp | 4.96×10-9 | 6.82×10-6 | 4.68×10-6 | 5.61×10-12 | 2.64×10-39 |
回答下列问题:
(1)加入NaOH溶液时,反应的离子方程式为 。向含有Mg2+、Fe3+的溶液中滴加NaOH溶液,当两种沉淀共存且溶液的pH=8时,c(Mg2+):c(Fe3+)= 。
(2)“母液”中除了含有Na+、CO32—外,还含有 等离子。
(3)有人从“绿色化学”角度设想将“母液”沿流程中虚线进行循环使用。请你分析在实际工业生产中是否可行: (填“可行”或“不可行”),并说明理由: 。
(4)已知:Na2CO3·10H2O(s)=Na2CO3(s)+10H2O(g)
 ="+532.36" kJ·mol-1
="+532.36" kJ·mol-1Na2CO3·10H2O(s)=Na2CO3·H2O(s)+9H2O(g)
 ="+473.63" kJ·mol-1
="+473.63" kJ·mol-1写出Na2CO3·H2O脱水反应的热化学方程式: 。
(7分)用中和滴定法测定烧碱的纯度,若烧碱中含有与酸不反应的杂质,试根据实验回答:
(1)将准确称取的4.3 g烧碱样品配制成250 mL待测液,需要的主要仪器除量筒、烧杯、玻璃棒、胶头滴管外,还必须用到的仪器有 。
(2)取待测液10.00 mL,用 滴定管量取,并置于锥形瓶中。
(3)向锥形瓶中滴加几滴指示剂,用0.200 mol·L-1标准盐酸滴定待测烧碱溶液。不适宜选用的指示剂为(选填序号):________。①石蕊试液 ②无色酚酞 ③甲基橙试液
(4)根据两次滴定获得的实验数据如下表,得出烧碱的纯度为 。
| 滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 10.00 | 0.50 | 20.40 |
| 第二次 | 10.00 | 4.00 | 24.10 |
A 酸式滴定管未用盐酸标准溶液润洗就直接注入盐酸标准溶液
B 锥形瓶用蒸馏水洗净后没有干燥就注入NaOH待测液
C 装有盐酸标准溶液的酸式滴定管在滴定前有气泡,滴定后气泡消失
D 读取HCl溶液体积时,开始仰视读数,滴定结束时俯视读数
E.若刚见到指示剂局部的颜色有变化就停止滴定
某烧碱样品中含有少量不与酸作用的可溶性杂质,为了测定其纯度,进行以下滴定操作:
| A.在250mL容量瓶中定容成250mL烧碱溶液; |
| B.用碱式滴定管移取25mL烧碱溶液于锥形瓶中并滴加几滴甲基橙作指示剂; |
| C.在天平上准确称取烧碱样品mg,在烧杯中加蒸馏水溶解; |
| D.将物质的量浓度为C mol·L-1的标准H2SO4溶液装入酸式滴定管,调整液面,记下开始刻度为V1mL; |
回答下列问题:
(1)正确操作步骤的顺序是(用字母填写)


 D
D  。
。(2)操作E中的锥形瓶下垫一张白纸的作用是 。
(3)操作D中液面应调整到 。
(4)滴定终点的现象是 。
(5)若酸式滴定管没有用标准H2SO4润洗,会对测定结果有何影响? (填“偏高”、“偏低”或“无影响”,其它操作均正确)。
(6)该烧碱样品的纯度计算式是 。
以KCl和ZnCl2混合液为电镀液在铁制品上镀锌,下列说法正确的是
| A.未通电前上述镀锌装置可构成原电池,锌为负极,电镀时锌与电源负极相连为阴极 |
| B.电镀时通过1mol电子,阴极上有0.5mol锌的析出 |
| C.未通电前K+向铁极移动,通电后K+还向铁极移动 |
| D.镀锌层破损后对铁制品失去保护作用 |
 L-1H2SO4洗涤Fe粉,主要反应的化学方程式为 ,之后用蒸馏水洗涤铁粉至中性;
L-1H2SO4洗涤Fe粉,主要反应的化学方程式为 ,之后用蒸馏水洗涤铁粉至中性;