题目内容
(16分)资料显示:镁与饱和碳酸氢钠溶液反应产生大量气体并生成白色不溶物
(1)提出假设
猜想①:白色不溶物可能为___
猜想②:白色不溶物可能为MgCO3
猜想③:白色不溶物可能是碱式碳酸镁
(2)定性实验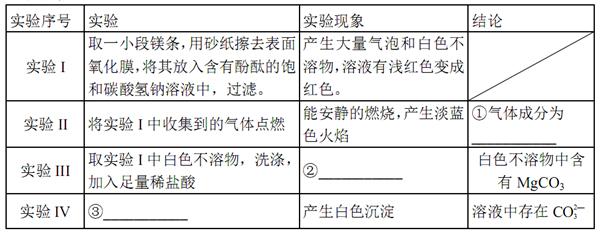
(3)定量实验:
称取实验I中所得干燥、纯净的白色不溶物14.2 g,充分加热至不在产生气体为止,并使分解
产生的气体全部通入如下装置中: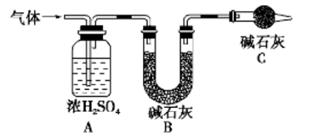
①实验测得装置A增重1.8 g,装置B增重4.4 g,则白色不溶物的化学式为_____
②装置C的作用为____,若移除装置C会导致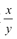 的值___(填“偏大”、“偏小”或“不变”
的值___(填“偏大”、“偏小”或“不变”
(4)探究原理
①请结合化学用语和化学平衡移动原理解释Mg与饱和NaHC03溶液反应产生大量气泡和白
色不溶物的原因:_______
②250C时,测得Mg与饱和NaHC03溶液反应所得混合体系的pH为10,则该体系中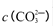
为(已知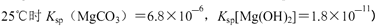
(16分)
(1)Mg(OH)2(1分)
(2)①氢气(1分) ②沉淀溶解,产生气泡(2分)
③取实验I中的澄清溶液少许于试管中,加入少量CaCl2溶液(2分)
(3)①MgCO3?Mg(OH)2[或Mg(OH)2?MgCO3或Mg2(OH)2CO3](2分)
②防止空气中的水蒸气和二氧化碳进入装置B引起实验误差(2分)
偏大(1分)
(4)①NaHCO3溶液中存在平衡:HCO3?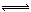 H++CO32?;H2O
H++CO32?;H2O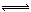 H++OH?,Mg和H+反应生成H2和Mg2+,使上述两平衡向右移动,c(CO32?)、c(OH?)均增大,Mg2+跟OH?、CO32?反应生成难溶物Mg(OH)2?MgCO3(3分)
H++OH?,Mg和H+反应生成H2和Mg2+,使上述两平衡向右移动,c(CO32?)、c(OH?)均增大,Mg2+跟OH?、CO32?反应生成难溶物Mg(OH)2?MgCO3(3分)
② 3.8×10-3mol?L?1(2分)
解析试题分析:(1)对比猜想②③,可知猜想①白色不溶物可能为Mg(OH)2.
(2)①气体能安静的燃烧,产生淡蓝色火焰,所以该气体为H2。
②结论为白色不溶物中含有MgCO3,所以加入足量稀盐酸,实验现象为:沉淀溶解,产生气泡。
③证明溶液中含有CO32?,所以现象为产生白色沉淀,所以实验操作为:取实验I中的澄清溶液少许于试管中,加入少量CaCl2溶液。
(3)①装置A增重1.8 g,生成了H2O为0.1mol,装置B增重4.4 g,生成CO2的物质的量为0.1mol,则白色不容物含有等物质的量的Mg(OH)2和MgCO3,所以白色不溶物的化学式为:MgCO3?Mg(OH)2[或Mg(OH)2?MgCO3或Mg2(OH)2CO3]
②装置C中含有碱石灰,能吸收水分和CO2,所以其作用为防止空气中的水蒸气和二氧化碳进入装置B引起实验误差;若移除装置C外界,空气中的水蒸气和二氧化碳进入装置B,而装置B增加的质量为产生的CO2的质量,所以造成测量的MgCO3的质量增大,导致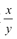 的值偏大。
的值偏大。
(4)①NaHCO3溶液中存在两个电离平衡:HCO3?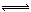 H++CO32?;H2O
H++CO32?;H2O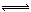 H++OH?,加入Mg后,Mg和H+反应生成H2和Mg2+,使上述两平衡向右移动,c(CO32?)、c(OH?)均增大,Mg2+跟OH?、CO32?反应生成难溶物Mg(OH)2?MgCO3。
H++OH?,加入Mg后,Mg和H+反应生成H2和Mg2+,使上述两平衡向右移动,c(CO32?)、c(OH?)均增大,Mg2+跟OH?、CO32?反应生成难溶物Mg(OH)2?MgCO3。
②pH为10,则c(OH?)=10-4mol?L?1,c(Mg2+)=Ksp[Mg(OH)2]÷c2(OH?)=1.8×10-11÷(10-4)2=1.8×10-3,c(CO32?)=" K" sp[MgCO3]÷c(Mg2+)=6.8×10-6÷(1.8×10-3)= 3.8×10-3mol?L?1
考点:本题考查实验方案的设计与分析、化学平衡、有关K sp的计算。

结合下表回答下列问题:
| 物 质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
| 溶度积/25℃ | 8.0×10-16 | 2.2×10-20 | 4.0×10-38 |
| 完全沉淀时的pH范围 | ≥9.6 | ≥6.4 | 3~4 |
(2)在空气中直接加热CuCl2?2H2O晶体得不到纯的无水CuCl2,由CuCl2?2H2O晶体得到纯的无水CuCl2的合理方法是___________________________________________。
工业碳酸钠(纯度约为98%)中含有Ca2+、Mg2+、Fe3+、Cl-和SO42—等杂质,提纯工艺线路如图所示: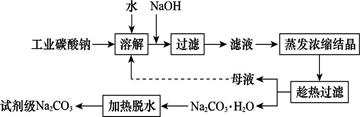
Ⅰ.碳酸钠的饱和溶液在不同温度下析出的溶质如图所示:
Ⅱ.有关物质的溶度积如下
| 物质 | CaCO3 | MgCO3 | Ca(0H)2 | Mg(OH)2 | Fe(OH)3 |
| Ksp | 4.96×10-9 | 6.82×10-6 | 4.68×10-6 | 5.61×10-12 | 2.64×10-39 |
回答下列问题:
(1)加入NaOH溶液时,反应的离子方程式为 。向含有Mg2+、Fe3+的溶液中滴加NaOH溶液,当两种沉淀共存且溶液的pH=8时,c(Mg2+):c(Fe3+)= 。
(2)“母液”中除了含有Na+、CO32—外,还含有 等离子。
(3)有人从“绿色化学”角度设想将“母液”沿流程中虚线进行循环使用。请你分析在实际工业生产中是否可行: (填“可行”或“不可行”),并说明理由: 。
(4)已知:Na2CO3·10H2O(s)=Na2CO3(s)+10H2O(g)
 ="+532.36" kJ·mol-1
="+532.36" kJ·mol-1Na2CO3·10H2O(s)=Na2CO3·H2O(s)+9H2O(g)
 ="+473.63" kJ·mol-1
="+473.63" kJ·mol-1写出Na2CO3·H2O脱水反应的热化学方程式: 。
(7分)用中和滴定法测定烧碱的纯度,若烧碱中含有与酸不反应的杂质,试根据实验回答:
(1)将准确称取的4.3 g烧碱样品配制成250 mL待测液,需要的主要仪器除量筒、烧杯、玻璃棒、胶头滴管外,还必须用到的仪器有 。
(2)取待测液10.00 mL,用 滴定管量取,并置于锥形瓶中。
(3)向锥形瓶中滴加几滴指示剂,用0.200 mol·L-1标准盐酸滴定待测烧碱溶液。不适宜选用的指示剂为(选填序号):________。①石蕊试液 ②无色酚酞 ③甲基橙试液
(4)根据两次滴定获得的实验数据如下表,得出烧碱的纯度为 。
| 滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 10.00 | 0.50 | 20.40 |
| 第二次 | 10.00 | 4.00 | 24.10 |
A 酸式滴定管未用盐酸标准溶液润洗就直接注入盐酸标准溶液
B 锥形瓶用蒸馏水洗净后没有干燥就注入NaOH待测液
C 装有盐酸标准溶液的酸式滴定管在滴定前有气泡,滴定后气泡消失
D 读取HCl溶液体积时,开始仰视读数,滴定结束时俯视读数
E.若刚见到指示剂局部的颜色有变化就停止滴定


 L-1H2SO4洗涤Fe粉,主要反应的化学方程式为 ,之后用蒸馏水洗涤铁粉至中性;
L-1H2SO4洗涤Fe粉,主要反应的化学方程式为 ,之后用蒸馏水洗涤铁粉至中性; Fe2+ + Ag+ ,可用Fe3+的盐溶液做刻蚀液将试管中的银镜洗去。
Fe2+ + Ag+ ,可用Fe3+的盐溶液做刻蚀液将试管中的银镜洗去。