题目内容
【题目】乙酸是醋的主要成分,而醋几乎贯穿了整个人类文明史,其中有文献记载的酿醋历史至少也在三千年以上。
(1)写出乙酸在水溶液中的电离方程式_____________
(2)25℃下,CH3COOH在水中电离的ΔH为+8.8kJ/mol,电离常数Ka为2×10-5,又知HCl(aq)与NaOH(aq)反应的ΔH为-57.3kJ/mol,则CH3COONa水解时的ΔH为_____,水解平衡常数为Kh为_______。
近年来,研究者利用乙酸开发出新工艺合成乙酸乙酯,使产品成本明显降低,其主要反应为:
CH2=CH2(g)+CH3COOH(l) ![]() CH3COOC2H5(l)
CH3COOC2H5(l)
(3)该反应属于有机反应类型中的_____________。
(4)下列描述能说明乙烯与乙酸合成乙酸乙酯的反应已达化学平衡的是____________。
A.乙烯、乙酸、乙酸乙酯的浓度相同
B.酯化合成反应的速率与酯分解反应的速率相等
C.乙烯断开1mol碳碳双键的同时乙酸恰好消耗1mol
D.体系中乙烯的百分含量一定
下图为n(乙烯)与n(乙酸)物料比为1时,在不同压强下进行了在相同时间点乙酸乙酯的产率随温度的变化的测定实验,实验结果如图所示。回答下列问题:
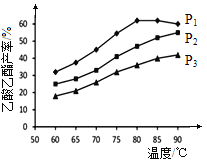
(5)温度在60~80℃范围内,乙烯与乙酸酯化合成反应速率由大到小的顺序是________[用![]() (P1)、
(P1)、![]() (P2)、
(P2)、![]() (P3)分别表示不同压强下的反应速率],分析其原因为____________。
(P3)分别表示不同压强下的反应速率],分析其原因为____________。
(6)压强为P1MPa、温度60℃时,若乙酸乙酯的产率为30℅,则此时乙烯的转化率为_______。
(7)压强为P1MPa、温度超过80℃时,乙酸乙酯产率下降的原因可能是_________。
【答案】 CH3COOH![]() CH3COO-+H+ +48.5kJ/mol 5×10-10 加成反应 BD v(P1)>v(P2)>v(P3) 其它条件相同时,对有气体参与的反应,压强越大化学反应速率越快 30% 由图像可知,P1MPa、80℃时反应已达平衡且正反应放热,故压强不变升高温度平衡逆向移动产率下降
CH3COO-+H+ +48.5kJ/mol 5×10-10 加成反应 BD v(P1)>v(P2)>v(P3) 其它条件相同时,对有气体参与的反应,压强越大化学反应速率越快 30% 由图像可知,P1MPa、80℃时反应已达平衡且正反应放热,故压强不变升高温度平衡逆向移动产率下降
【解析】本题分析:本题主要考查化学平衡。
(1)乙酸是弱酸,在水溶液中的电离方程式须使用可逆符号,其电离方程式为CH3COOH![]() CH3COO-+H+。
CH3COO-+H+。
(2)已知①CH3COOH (aq)![]() CH3COO-(aq)+H+ (aq) ΔH1=+8.8kJ/mol,
CH3COO-(aq)+H+ (aq) ΔH1=+8.8kJ/mol,
②H+(aq)+OH- (aq)= H2O (l) ΔH2=-57.3kJ/mol,
反应-(①+②)得CH3COO-(aq)+H2O (l)![]() CH3COOH(aq)+OH-(aq) ΔH=-(ΔH1+ΔH2)= +48.5kJ/mol,则CH3COONa水解时的ΔH为+48.5kJ/mol。
CH3COOH(aq)+OH-(aq) ΔH=-(ΔH1+ΔH2)= +48.5kJ/mol,则CH3COONa水解时的ΔH为+48.5kJ/mol。
水解平衡常数Kh=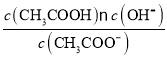 =
=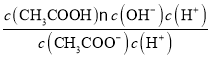 =
=![]() =
=![]() =5×10-10。
=5×10-10。
(3)该反应属于有机反应类型中的加成反应。
(4)A.与反应是否已达化学平衡没有关系;B.正反应速率与逆反应速率相等,反应已达化学平衡;C.都是反应物之间的关系,不能说明与反应已达化学平衡;D.反应已达化学平衡,故选BD。
(5)温度在60~80℃范围内,乙烯与乙酸酯化合成反应速率由大到小的顺序是v(P1)>v(P2)>v(P3),其原因为其它条件相同时,对有气体参与的反应,压强越大化学反应速率越快。
(6)压强为P1MPa、温度60℃时,若乙酸乙酯的产率为30℅,则此时乙烯的转化率为30%。
(7)压强为P1MPa、温度超过80℃时,乙酸乙酯产率下降的原因可能是:P1MPa、80℃时反应已达平衡,该反应为放热反应,在压强不变时升高温度平衡逆向移动,致使产率下降。

【题目】如图所示,室温时甲、乙两个容积相等的烧瓶中分别集满了两种气体(同温、同压),当取下止水夹K,使两瓶内气体充分接触后,容器内压强最小的是( )
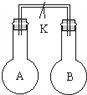
编号 | A | B | C | D |
甲中气体 | H2S | H2 | NH3 | NO |
乙中气体 | SO2 | Cl2 | HCl | O2 |
A. A B. B C. C D. D
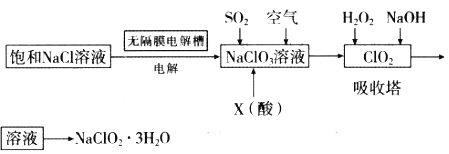
【题目】氯化亚铜广泛应用于有机合成。工业上以低品位铜矿(主要含CuS、Fe2O3、SiO2)为原料,制备氯化亚铜的生产工艺如下:
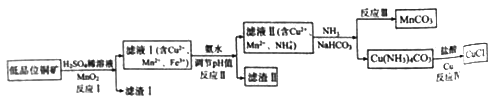
(1)CuS中Cu的化合价为_____________。
(2)滤渣Ⅰ的成分除S之外还有__________,反应Ⅰ中MnO2的作用是______________
(3)已知生成氢氧化物的pH如下表:
沉淀物 | Fe(OH)3 | Mn(OH)2 | Cu(OH)2 |
开始沉淀的pH | 2.7 | 8.3 | 4.2 |
完全沉淀的pH | 3.2 | 9.8 | 6.7 |
则反应Ⅱ中用氨水调节pH值的范围是________________。
(4)检验滤液Ⅱ中是否含有Fe3+的试剂是____________。
(5)请用化学用语回答:
①反应中Ⅲ生成难溶MnCO3的离子方程式_____________;
②反应Ⅳ素所对应的化学方程式____________________。
(6)氯化亚铜的定量分析:
步骤Ⅰ.称取0.2500g的样品和10.0mL 1.0mol/L的FeCl3溶液置于250mL锥形瓶中,不断摇动;
步骤Ⅱ.待样品溶解后,加水10.0mL和3滴指示剂;
步骤Ⅲ.用0.1000mol/L CeOSO4标准溶液滴至终点,并记录读数。重复实验两次,测得数据如下:
序号 | 1 | 2 | 3 |
起始读数 | 0.95mL | 0.70mL | 1.00mL |
终点读数 | 20.95mL | 24.95mL | 21.00mL |
已知:CuCl+FeCl3=CuCl2+FeCl2 Fe2++Ce4+=Fe3++Ce3+
①数据处理:计算CuCl纯度________________;
②误差分析:下列操作会使滴定结果偏高的是__________________。
A.锥形瓶中有少量蒸馏水
B.滴定终点读数时仰视滴定管刻度线,其他操作正确
C.0.1000mol/L CeOSO4溶液久置后浓度变小
D.滴定前滴定管尖嘴有气泡,滴定后气泡消失
E.所取FeCl3溶液体积偏大