��Ŀ����
����Ŀ����ͼ��ʾ��ѧ��Ӧ�����е������仯����ͼ�ж�����˵���к��������� ��
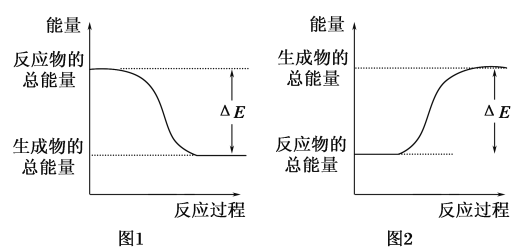
A��500mL 2.0mol��L��1 HCl��500mL 2.0mol��L��1 NaOH�ķ�Ӧ����ͼ1���Ҧ�E��57.3kJ
B��500mL 2.0mol��L��1 H2SO4��500mL 2.0mol��L��1 Ba��OH��2�ķ�Ӧ����ͼ2���Ҧ�E��114.6kJ
C������ͼ1�����仯���κη�Ӧ��һ��������ȼ��ɷ���
D��CaO��Ũ��������ˮʱ�������仯����ͼ1
���𰸡�A
��������ͼ1��ʾ���ȷ�Ӧ��ͼ2��ʾ���ȷ�Ӧ��ѡ��B�Ƿ��ȷ�Ӧ���ʴ���ѡ��A,1mol H����1mol OH����Ӧ�ų�57.3kJ��������ȷ��ѡ��C��һЩ���ȷ�Ӧ����Ȳ��ܷ������ʴ���ѡ��D��Ũ��������ˮ��Ȼ��ų��������������ڻ�ѧ��Ӧ���ʴ���

��ϰ��ϵ�д�
�����Ŀ