题目内容
15.一定温度下,向a L密闭容器中加入1mol X气体和2mol Y气体,发生如下反应;X(g)+2Y(g)?2Z(g),此反应达到平衡的标志是( )| A. | 容器气体密度不随时间变化 | |
| B. | 容器内X、Y、Z的浓度之比为1:2:2 | |
| C. | 容器内各物质的浓度不随时间变化 | |
| D. | 单位时间消耗0.1 mol X同时生成0.2 mol Z |
分析 由X(g)+2Y(g) 2Z(g)可知,该反应前后的化学计量数之和不等,然后根据达到平衡时,正逆反应速率相等,但不等于零,各物质的浓度不再改变判断.
2Z(g)可知,该反应前后的化学计量数之和不等,然后根据达到平衡时,正逆反应速率相等,但不等于零,各物质的浓度不再改变判断.
解答 解:A、反应前后总质量不变,体积也没变,所以密度一直不变,所以密度不随时间变化不是平衡化学平衡状态的依据,故A错误;
B、反应达到平衡时的浓度与反应的初始物质的量以及反应的转化程度有关,所以不能确定是否达到平衡,故B错误;
C、反应达平衡时,各物质的浓度不再随时间改变,所以压强不再变化,故C正确;
D、无论反应是否达到化学平衡,消耗的反应物的物质的量之比等于计量数之比,所以不能用来作为判断是否达到平衡状态的依据,故D错误;
故选C.
点评 本题考查了化学平衡状态的判断,难度不大,平衡状态的本质是正逆反应速率相等,化学平衡状态的判断常以选择题方式考查.

练习册系列答案
相关题目
3.下列物质中既含有离子键,又含有非极性共价键的是( )
| A. | NaOH | B. | Na2O2 | C. | MgCl2 | D. | CH4 |
10.短周期元素的离子aW2+、bX+、cY2-、dZ-都具有相同的电子层结构,下列推断正确的是( )
| A. | 原子半径:X>W>Y>Z | B. | 热稳定性:H2Y>HZ | ||
| C. | 离子半径:Y2->Z->W2+>X+ | D. | 碱性:W(OH)2>XOH |
20.实验是研究化学的基础.关于各装置图的叙述中,正确的是( )
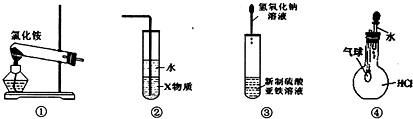

| A. | 装置①常用于实验室制取氨 | |
| B. | 装置②中X若为苯,可用于吸收氨气,并防止倒吸 | |
| C. | 装置③可用于制备氢氧化亚铁并观察其颜色 | |
| D. | 装置④可验证HCl气体在水中的溶解性 |
7.下列有关化学用语使用正确的是( )
| A. | 次氯酸的结构式:H-Cl-O | B. | CO2的比例模型 | ||
| C. | NH4Cl的电子式: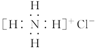 | D. | 苯乙烯的结构简式: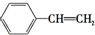 |
4.蔗糖酯是联合国国际粮农组织和世界卫生组织推荐使用的食品乳化剂.某蔗糖酯可由蔗糖与硬脂酸乙酯合成,反应如下:
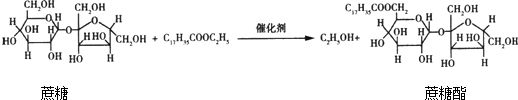
有关说法不正确的是( )

有关说法不正确的是( )
| A. | 蔗糖酯可看成是由高级脂肪酸和蔗糖形成的酯 | |
| B. | 合成该蔗糖酯的反应属于取代反应 | |
| C. | 蔗糖不能发生银镜反应,而它的同分异构体纤维二糖则能发生银镜反应 | |
| D. | 该蔗糖酯在稀硫酸作用下水解,水解后只有硬脂酸和葡萄糖两种产物 |
12.有两份溶液,其中所含溶质相同,设其摩尔质量为Mg/mol.根据如表信息,回答有关问题:
(1)第一份溶液中,溶质的物质的量浓度为$\frac{1000{ρ}_{1}{w}_{1}}{M}$mol/L.
(2)取等质量两份溶液混合,则所得混合液中溶质的质量分数ω3=$\frac{(ω1+ω2)}{2}$.
(3)若有ω1>ω2,取等体积的两份溶液混合,设所得混合液中溶质的质量分数为ω4,试比较ω3、ω4的相对大小若ρ1>ρ2,则ω4>ω3;若ρ1<ρ2,则ω3>ω4.
| 溶质的质量分数 | 溶液的密度(g•cm-3) | |
| 第一份溶液 | ω1 | ρ1 |
| 第二份溶液 | ω2 | ρ2 |
(2)取等质量两份溶液混合,则所得混合液中溶质的质量分数ω3=$\frac{(ω1+ω2)}{2}$.
(3)若有ω1>ω2,取等体积的两份溶液混合,设所得混合液中溶质的质量分数为ω4,试比较ω3、ω4的相对大小若ρ1>ρ2,则ω4>ω3;若ρ1<ρ2,则ω3>ω4.
 运用相关原理,回答下列各小题:
运用相关原理,回答下列各小题: Fe(OH)3(胶体)+3H+.
Fe(OH)3(胶体)+3H+.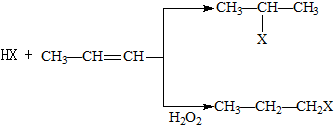 (X为卤素原子)
(X为卤素原子)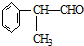 的物质,该物质是一种香料.
的物质,该物质是一种香料.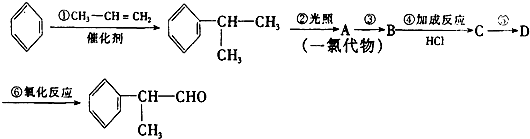
 ;
; +HCl$\stackrel{H_{2}O_{2}}{→}$
+HCl$\stackrel{H_{2}O_{2}}{→}$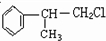 ;
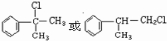
;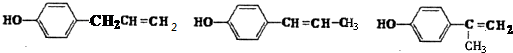 其中两种.
其中两种.