题目内容
【题目】钠,镁,铝,铁四种金属组成的混合物6 g,与足量的稀硫酸反应,产生标准状况下的氢气6.72 L,由此判断混合物中必含 ( )
A.钠B.镁C.铝D.铁
【答案】C
【解析】
标准状况下6.72 L氢气的物质的量=![]() =0.3 mol,故6g混合物提供的电子为0.3 mol×2=0.6 mol,则提供1mol电子需要金属混合物的质量为6g×
=0.3 mol,故6g混合物提供的电子为0.3 mol×2=0.6 mol,则提供1mol电子需要金属混合物的质量为6g×![]() =10g,Mg在反应中表现+2价,提供1mol电子需要Mg的质量为24g/mol×
=10g,Mg在反应中表现+2价,提供1mol电子需要Mg的质量为24g/mol×![]() =12g,Al在反应中表现+3价,提供1mol电子需要Al的质量为27g/mol×
=12g,Al在反应中表现+3价,提供1mol电子需要Al的质量为27g/mol×![]() =9g,Fe在反应中表现+2价,提供1mol电子需要Fe的质量为56g/mol×
=9g,Fe在反应中表现+2价,提供1mol电子需要Fe的质量为56g/mol×![]() =28g,Na在反应中表现+1价,提供1mol电子需要Na的质量为23g/mol×1mol=23g,提供1mol电子,只有Al的质量小于10g,其它金属的质量都大于10g,故金属混合物中一定有Al,故选C。
=28g,Na在反应中表现+1价,提供1mol电子需要Na的质量为23g/mol×1mol=23g,提供1mol电子,只有Al的质量小于10g,其它金属的质量都大于10g,故金属混合物中一定有Al,故选C。

【题目】某地菱锰矿的主要成分为MnCO3,还含有少量的FeCO3、CaCO3、Al2O3等杂质。工业上以菱锰矿为原料制备高纯度碳酸锰的流程如图所示:
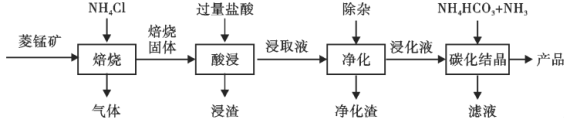
已知:MnCO3+2NH4Cl=MnCl2+CO2↑+2NH3↑+H2O.
相关金属离子[c0(Mn+)=0.1mol·L-1]形成氢氧化物沉淀的pH范围如下:
金属离子 | Mn2+ | Fe2+ | Fe3+ | Al3+ |
开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 |
沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 |
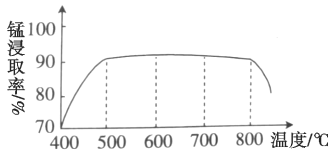
(1)焙烧时温度对锰浸取率的影响如图。焙烧时适宜的温度为___________左右;800℃以上锰的浸取率偏低,可能的原因是___________。
(2)净化包含三步:①加入少量MnO2,添加少量MnO2的作用是____________。发生反应的离子方程式为___________。
②加氨水调pH,溶液的pH范围应调节为___________~8.1之间。生成的沉淀主要是___________。
③加入MnF2,沉淀除去Ca2+,若溶液酸度过高,Ca2+沉淀不完全,原因是___________。
(3)碳化结晶中生成MnCO3的离子方程式为____________。