题目内容
14.根据要求完成下列问题:(1)某元素原子共有4个价电子,其中2个价电子位于第三能层d轨道,试回答:该元素核外价电子排布图
 ,基态原子核外电子排布式1s22s22p63s23p63d24s2.该元素的原子序数为22,该元素是金属元素(填“金属”或“非金属”).
,基态原子核外电子排布式1s22s22p63s23p63d24s2.该元素的原子序数为22,该元素是金属元素(填“金属”或“非金属”).(2)指出配合物K3[Co(CN)6]中的中心离子、配位体及其配位数:Co3+、CN-、6.
(3)下列分子中若有手性原子,请用“*”标出其手性碳原子.
(4)在下列物质①PCl3②NH3③CCl4④CO2⑤SO2 ⑥BF3⑦SO3⑧H2O中,属于非极性分子的是(填编号)③④⑥⑦.
(5)试比较下列含氧酸的酸性强弱(填“>”、“<”或“=”):H3PO4>H3PO3; HClO4>HClO3; H2SO3<H2SO4.
(6)根据价层电子对互斥理论判断下列问题:
①NH3中心原子的杂化方式为sp3杂化,VSEPR构型为正四面体,分子的立体构型为三角锥形.
②BF3分子中,中心原子的杂化方式为sp2杂化,分子的立体构型为平面三角形.
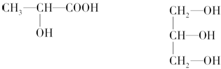
(7)H2O的沸点(100℃)比H2S的沸点(-61℃)高,这是由于水分子之间存在氢键.
分析 (1)某元素原子共有4个价电子,其中2个价电子位于第三能层d轨道,价电子排布式为3d24s2,其基态原子核外电子排布式为:1s22s22p63s23p63d24s2,处于第四周期ⅥB族,为金属元素;
(2)根据配合物K3[Co(CN)6]结构分析中心离子为Co3+、配体为CN-、配位数为6;
(3)连接4个不同原子或原子团的碳原子为手性碳原子.
(4)不同非金属元素之间易形成极性键,正负电荷重心重合的分子为非极性分子;
(5)同一元素的含氧酸,该元素的化合价越高,对应的含氧酸的酸性越强;
(6)①N原子价层电子对个数=σ键个数+孤电子对个数,据此分析解答;
②BF3分子中,B原子孤电子对数=$\frac{3-1×3}{2}$=0,价层电子对数=3,据此分析解答;
(7)根据氢键进行分析.
解答 解:(1)某元素原子共有4个价电子,其中2个价电子位于第三能层d轨道,其价电子排布图为: 该元素为Ti元素,原子核外有22个电子,根据构造原理知,其基态原子核外电子排布式为:1s22s22p63s23p63d24s2,该元素位于第四周期第IVB族,为金属元素,
该元素为Ti元素,原子核外有22个电子,根据构造原理知,其基态原子核外电子排布式为:1s22s22p63s23p63d24s2,该元素位于第四周期第IVB族,为金属元素,
故答案为: ;1s22s22p63s23p63d24s2;22;金属;
;1s22s22p63s23p63d24s2;22;金属;
(2)根据配合物K3[Co(CN)6]结构分析,含有空轨道的金属阳离子为中心离子,所以中心离子为Co3+、有孤对电子的原子或离子为配体,所以配体为CN-、配位数就是配体的个数,所以配位数为6,
故答案为:Co3+;CN-;6;
(3)连接4个不同原子或原子团的碳原子为手性碳原子,所以手性碳原子分别为: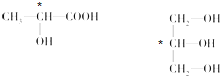 ,故答案为:
,故答案为: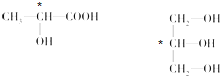 ;
;
(4)①PCl3中P元素化合价为+3,P原子最外层5个电子未全部成键,为极性分子;
②NH3中C元素化合价为-3,N原子最外层5个电子未全部成键,为极性分子;
③CCl4中C元素化合价为+4,C原子最外层4个电子全部成键,为非极性分子;
④CO2中C元素化合价为+4,C原子最外层4个电子全部成键,为非极性分子;
⑤SO2中S元素化合价为+4,S原子最外层6个电子未全部成键,为极性分子;
⑥BF3中B元素化合价为+3,B原子最外层3个电子全部成键,为非极性分子;
⑦SO3中S元素化合价为+6,S原子最外层6个电子全部成键,为非极性分子;
⑧H2O中O元素化合价为-2,O原子最外层6个电子未全部成键,为极性分子;
故选:③④⑥⑦;
(5)同一元素的含氧酸,该元素的化合价越高,对应的含氧酸的酸性越强,故酸性:H3PO4>H3PO3,HClO4>HClO3,H2SO3<H2SO4,
故答案为:>;>;<;
(6)①NH3分子中心N原子孤电子对数=$\frac{5-1×3}{2}$=1,价层电子对数=3+1=4,故N原子采取sp3杂化,VSEPR构型为正四面体,分子的立体构型为三角锥形,
故答案为:sp3;正四面体;三角锥形;
②BF3分子中,B原子孤电子对数=$\frac{3-1×3}{2}$=0,价层电子对数=3,故B原子采取sp2杂化,分子的立体构型为平面三角形,
故答案为:sp2;平面三角形;
(7)水分子之间存在氢键,沸点高于同族其它元素氢化物,故答案为:水分子之间存在氢键.
点评 本题是对物质结构的考查,涉及核外电子排布、分子结构与性质、价层电子对互斥理论等,难度不大,侧重对基础知识巩固.

| A. | 加入少量的碳酸钠固体 | B. | 通入CO2 | ||
| C. | 加入少量盐酸 | D. | 加入少量氢氧化钙固体 |
| A. | 金属与非金属分界线附近 | B. | 非金属区域 | ||
| C. | 过渡元素 | D. | 左下方的金属元素区域 |
| A. | Ca(OH)2 | B. | NaOH | C. | KOH | D. | Al(OH)3 |
| A. | 同一周期中,碱金属元素的第一电离能最大 | |
| B. | 同周期元素中,ⅦA族元素的原子半径最大 | |
| C. | 当各轨道处于全满、半满、全空时原子较稳定 | |
| D. | ⅥA族元素的原子,其半径越大,越容易得到电子 |
| A. | 三种元素对应的氧化物均为碱性氧化物 | |
| B. | 三者的单质长期放置在空气中均能被腐蚀 | |
| C. | 制备AlCl3、FeCl3、CuCl2均不能采用将溶液直接蒸干的方法 | |
| D. | 电解AlCl3、FeCl3、CuCl2的混合溶液时,阴极上依次析出Cu、Fe、Al |
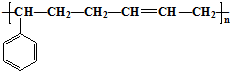 合成这种橡胶的单体应是( )
合成这种橡胶的单体应是( )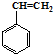 ②
②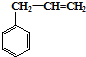 ③CH3-CH=CH-CH3④CH≡C-CH3⑤CH2=CH-CH=CH2.
③CH3-CH=CH-CH3④CH≡C-CH3⑤CH2=CH-CH=CH2. (1)熔点沸点HF>HI;原因:HF分子间含有氢键
(1)熔点沸点HF>HI;原因:HF分子间含有氢键