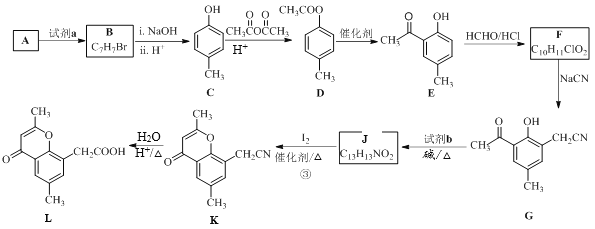
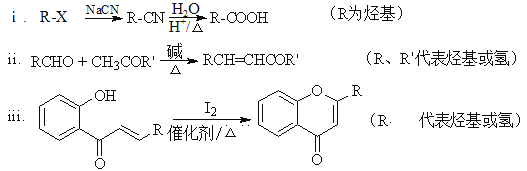
题目内容
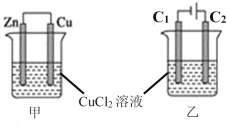
【题目】将铜粉放入稀硫酸中,加热后无明显现象,但当加入某物质后,铜粉质量减少,溶液呈蓝色且有气体逸出,此物质是( )
A. Na2CO3 B. KNO3 C. NaOH D. HCl
【答案】B
【解析】加入碳酸钠时与稀硫酸反应生成二氧化碳气体,但铜不参与反应,质量不会减少,A错误;铜、稀硫酸、硝酸钾混合时发生反应3Cu+8H++2NO3-=3 Cu2++2NO↑+4H2O,则铜粉质量减轻,同时溶液逐渐变为蓝色,且有气体逸出,B正确;NaOH与稀硫酸发生中和反应,但铜不参与反应,质量不会减少,C错误;铜粉放入稀硫酸、HCl混合液中不发生反应,铜粉质量不会减少,溶液不会呈蓝色且没有气体逸出,D错误;正确选项B。

【题目】甲醇是一种可再生能源,具有广泛的开发和应用前景。工业上一般采用下列两种反应合成甲醇。
反应Ⅰ:CO(g)+2H2(g) ![]() CH3OH(g),△H1
CH3OH(g),△H1
反应Ⅱ:CO2(g)+3H2(g) ![]() CH3OH(g)+ H2O(g),△H2
CH3OH(g)+ H2O(g),△H2
下表所列数据是反应I在不同温度下的化学平衡常数(K):
温度 | 250℃ | 300℃ | 350℃ |
K | 2.0 | 0.27 | 0.012 |
(1)在一定条件下将2 molCO和6molH2充入2L的密闭容器中发生反应I,5min后测得c(CO)=0.4 mol/L,计算此段时间的反应速率(用H2表示)___________ mol/(L·min)。
(2)由表中数据判断△H1_____0(填“>”、“<”或“=”)反应,C02(g)+H2(g)![]() CO(g)+H20(g) △H3=____(用△H1和△H2表示)。
CO(g)+H20(g) △H3=____(用△H1和△H2表示)。
(3)若容器容积不变,下列措施可提高反应Ⅰ中CO转化率的是_________(选字母)。
a.充入CO,使体系总压强增大
b.将CH3OH(g)从体系中分离
e.充入He,使体系总压强增大
d.使用高效催化剂
(4)写出反应Ⅱ的化学平衡常数表达式:K=_________;保持恒温恒容的条件下将反应Ⅱ的平衡体系各物质浓度均增加一倍,则化学平衡_________(填“正向”、“逆向”或“不”)移动,平衡常数K____(填“变大”、“变小”或“不变”)。