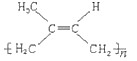
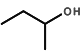
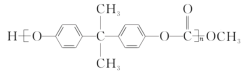
��Ŀ����
����Ŀ��ijͬѧ������������ȡ��������(��Ҫ�ɷ�ΪFe2O3��SiO2��Al2O3����������������)��ȡ��ˮ����������(FeSO4��7H2O)��������������̣�

����˵������ȷ���ǣ� ��
A. �ܽ�����ѡ���������ᣬ�Լ�Xѡ������
B. ����1��һ������SiO2������pH��Ϊ��ʹAl3+ת��ΪAl(OH)3���������2
C. ����Һ2�õ�FeSO4��7H2O��Ʒ�Ĺ����У������������ֹ�������ͷֽ�
D. ���ı䷽��������Һ1��ֱ�Ӽ�NaOH���������õ��ij����������ܽ⣬����Һ���ᾧ����Ҳ�ɵõ�FeSO4��7H2O
���𰸡�D
��������
A�����������ͼ���������Fe2O3��Al2O3��ת��Ϊ�����Σ���ȥSiO2��Ȼ�������ۻ�ԭFe3+�õ�����������A��ȷ��B������1ΪSiO2������FeSO4��Al2(SO4)3���õ��ǵ���pH�ķ�����ʹAl3+ת��ΪAl(OH)3�����Ӷ���FeSO4���룬B����ȷ��C��Fe2+���ױ������������ڵõ�FeSO4��7H2O��Ʒ�Ĺ����У�Ҫ��ֹ�䱻�����ͷֽ⣬C��ȷ��D������Һ1��ֱ�Ӽӹ�����NaOH�õ�����Fe(OH)2��������Fe(OH)2���ȶ��������ױ�����ΪFe(OH)3�������Ļ����������õIJ�Ʒ���������н϶������Fe2(SO4)3��D����ȷ����ѡD��

����Ŀ����T�������£���1L�̶�������ܱ�����M�м���2 mol X��1 mol Y���������·�Ӧ�� 2X(g) + Y(g) ![]() a Z(g) + W(g) ��H = ��Q kJ��mol��1 (Q>0)������Ӧ�ﵽƽ���Ӧ�ų�������ΪQ1 kJ������X��ת����Ϊ������ƽ����������¶ȣ���������ƽ����Է���������С����
a Z(g) + W(g) ��H = ��Q kJ��mol��1 (Q>0)������Ӧ�ﵽƽ���Ӧ�ų�������ΪQ1 kJ������X��ת����Ϊ������ƽ����������¶ȣ���������ƽ����Է���������С����
��1����ѧ������a��ֵΪ____________________���˷�Ӧ���淴Ӧ��S__________0 (�,��,��)��
��2������˵������˵���÷�Ӧ�ﵽ�˻�ѧƽ��״̬����___________________________��
A��������ѹǿһ�� B��v(X)��=2 v (Y)��
C��������Z������һ�� D�����������������һ��
E��������������ܶ�һ�� F��X��Y��Z��W��Ũ��֮��Ϊ2��1��a��1
��3��ά���¶Ȳ��䣬����ʼʱ��������м�������ʵ��������и����Ӧ�ﵽƽ���(ϡ�����岻���뷴Ӧ),��֮�ǵ�Чƽ�����______________��
A��2 mol X��1mol Y��1mol Ar B��a mol Z��1mol W
C��1 molX��0.5mol Y��0.5a mol Z��0.5 mol W D��2 mol X��1mol Y��1mol Z
��4��ά���¶Ȳ��䣬����ʼʱ�������м���4mol X��6 mol Y������ƽ��ʱ�����ڵ�ѹǿ��С��15%����Ӧ�зų�������Ϊ___________________kJ��
��5����֪���÷�Ӧ��ƽ�ⳣ�����¶ȵı仯���±���
�¶�/�� | 150 | 200 | 250 | 300 | 350 |
ƽ�ⳣ��K | 9.94 | 5.2 | 1 | 0��5 | 0��21 |
�Իش��������⣺
����ij�¶��£�2 mol X��1 mol Y�ڸ������з�Ӧ��ƽ�⣬ X��ƽ��ת����Ϊ50��������¶�Ϊ__________________�档