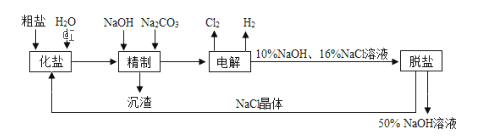
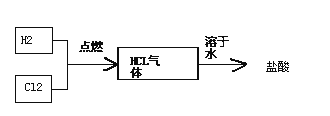
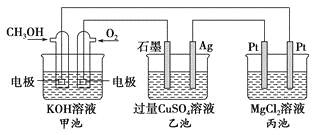
题目内容
【题目】钛、铬、铁、镍、铜等金属及其化合物在工业上有重要用途。
(1)向CuSO4溶液中逐滴滴加氨水至过量,过程中会先有沉淀生成,后沉淀逐渐溶解。
①写出沉淀溶解过程的离子方程式___________________。
②Cu2+基态时核外电子排布式为____________________。
③金属铜采取_____堆积。
④NH3分子空间构型为__________________。
(2)制备CrO2Cl2的反应为:K2Cr2O7+3CCl4=2KC1+2CrO2Cl2+3COC12↑。
①上述化学方程式中非金属元素电负性由大到小的顺序是_____________(用元素符号表示)。
②COCl2分子中所有原子均满足8电子构型,COCl2分子中σ键和π键的个数比为_____,中心原子的杂化方式为____________________。
(3)NiO、FeO的晶体结构均与氯化钠的晶体结构相似,其中Ni2+和Fe2+的离子半径分别为6.9×10-2nm和7.8×10-2nm,则熔点:NiO____FeO(填“>”、“<”或“=”)。
(4)Ni和La的合金是目前使用广泛的储氢材料。具有大容量、高寿命、耐低温等特点,在日本和中国己实现了产业化。该合金的晶胞结构如下图所示。

①该晶体的化学式为_______________________。
②已知该晶胞的摩尔质量为Mg/mol,密度为dg·cm-3。设NA为阿伏加德罗常数的值,则该晶胞的体积是_________cm3(用含M、d、NA的代数式表示)。
【答案】 Cu(OH)2+4NH3H2O=[Cu(NH3)4]2++2OH-+4H2O 1s22s22p63s23p63d9或[Ar]3d9 面心立方最密堆积 三角锥形 O>Cl>C 3:1 sp2 > LaNi5 M/NAd
【解析】本题考查物质结构与性质。
解析:(1)①向CuSO4溶液中逐滴滴加氨水时,先生成蓝色的氢氧化铜沉淀,继续滴加氨水,蓝色的氢氧化铜沉淀与氨水反应,生成深蓝色溶液的铜氨络离子,反应的离子方程式为:Cu2++2NH3H2O=Cu(OH)2↓+2NH4+,Cu(OH)2+4NH3H2O=[Cu(NH3)4]2++2OH-+4H2O;②Cu原子核外电子排布为1s22s22p63s23p63d104s1,4s与3d能级各失去1个电子形成Cu2+,则Cu2+基态核外电子排布式为1s22s22p63s23p63d9;③金属Cu采取面心立方堆积;④NH3分子中N原子的价层电子对数为4,孤对电子对数为1,则空间构型为三角锥形。(2)①反应中有O、C、Cl三种非金属元素参与反应,元素的非金属性越强,电负性越大,非金属性强弱顺序为O>Cl>C,由大到小的顺序是O>Cl>C;②由题意可知,COCl2分子中含有1个C、O双键和2个C、Cl单键,单键都是σ键,双键中1个为σ键和1个π键,则COCl2分子中σ键和π键的个数比为3∶1;因分子中含有C、O双键,所以C原子为sp2杂化。(3)Ni0、Fe0的晶体结构类型均与氯化钠的相同,说明二者都是离子晶体,离子晶体的熔点与离子键的强弱有关,离子所带电荷数越多,离子半径越小,离子键越强,熔点越高.由于Ni2+的离子半径小于Fe2+的离子半径,属于熔点是NiO>FeO。(4)①从图中可以看出,La位于平行六面体的顶点,晶胞中La的原子数为8×![]() =1,平行六面体的上、下两个面各有2个Ni原子,四个侧面各有1个Ni原子,体心还有1个Ni原子,晶胞中Ni的原子数为8×
=1,平行六面体的上、下两个面各有2个Ni原子,四个侧面各有1个Ni原子,体心还有1个Ni原子,晶胞中Ni的原子数为8×![]() +1=5,则该晶体的化学式为LaNi5;②晶胞中含有1个LaNi5,晶胞的质量为
+1=5,则该晶体的化学式为LaNi5;②晶胞中含有1个LaNi5,晶胞的质量为![]() ×M, 根据m=dV,晶胞的体积为
×M, 根据m=dV,晶胞的体积为![]() cm3。点晴:本题难点是晶胞结构的分析与与有关计算。使用均摊法计算晶胞微粒个数时,应意晶胞的形状,不同形状的晶胞应先分析任意位置上的一个微粒被几个晶胞所共有,如六棱柱晶胞中顶点、侧棱点、底面棱点和面心点依次被6、3、4、2不晶胞所共有。
cm3。点晴:本题难点是晶胞结构的分析与与有关计算。使用均摊法计算晶胞微粒个数时,应意晶胞的形状,不同形状的晶胞应先分析任意位置上的一个微粒被几个晶胞所共有,如六棱柱晶胞中顶点、侧棱点、底面棱点和面心点依次被6、3、4、2不晶胞所共有。