题目内容
12.将1.800g FeC2O4•2H2O固体放在一个可称量的容器中加热,分解产物为CO、CO2、H2O与铁的氧化物,已知500℃时残留固体质量为0.800g,则此时所得气体的平均摩尔质量为( )| A. | 25g/mol | B. | 27g/mol | C. | 30g/mol | D. | 32g/mol |
分析 n(FeC2O4•2H2O)=1.800g180g/mol=0.01mol,含Fe为0.01mol×56g/mol=0.56g,500℃时残留固体质量为0.800g,则含O元素为0.800g−0.56g16g/mol=0.015mol,则n(Fe):n(0)=0.01mol:0.015mol=2:3,可知铁的氧化物为Fe2O3,则发生2FeC2O4•2H2O△_3CO↑+CO2↑+4H2O(g)↑+Fe2O3,结合M=mn计算.
解答 解:n(FeC2O4•2H2O)=1.800g180g/mol=0.01mol,含Fe为0.01mol×56g/mol=0.56g,500℃时残留固体质量为0.800g,则含O元素为0.800g−0.56g16g/mol=0.015mol,则n(Fe):n(0)=0.01mol:0.015mol=2:3,可知铁的氧化物为Fe2O3,则发生2FeC2O4•2H2O△_3CO↑+CO2↑+4H2O(g)↑+Fe2O3,
由反应可知,0.01mol固体分解生成0.015molCO、0.005molCO2、0.02molH2O(g),
则此时所得气体的平均摩尔质量为(28×0.015+44×0.005+18×0.02)g0.04mol=25g/mol,
故选A.
点评 本题考查氧化还原反应的计算,为高频考点,把握铁的氧化物及发生的反应为解答的关键,注意利用元素守恒及化学反应方程式确定气体的组成,侧重分析与计算能力的考查,题目难度中等.

练习册系列答案
相关题目
2.将ag的铜丝灼烧变黑,趁热放入物质B中,铜丝变为红色,且质量不变,则B为( )
| A. | 盐酸 | B. | 乙醇 | C. | 醋酸 | D. | 硝酸 |
20.下列说法中正确的是( )
| A. | 2-甲基丁烷与正丁烷的一氯取代产物的种类相同 | |
| B. | 分子式为C4H8O2且含 基团的同分异构体共有4种 基团的同分异构体共有4种 | |
| C. | 与CH2═CHCH3与HCl发生加成反应可得到2种有机物 | |
| D. | 分子式C8H10的苯的同系物共有3种结构 |
7.下列叙述正确的是( )
| A. | 含有5个碳原子的烷烃,每个分子中最多可形成5个C-C单键 | |
| B. | 正丁烷中四个碳原子在同一条直线上 | |
| C. | 所有烷烃中都存在碳碳单键 | |
| D. | 二氯甲烷只有一种结构 |
17.已知:Br(CH2)BrNaCN→NC(CH2)CN→HCl水解HOOC(CH2)COOH
用乙烯和其他无机物为原料合成环状有机物E(C6H8O4)的流程如图:
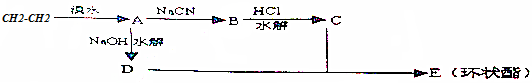
试写出A、B、C、D、E的结构简式.
用乙烯和其他无机物为原料合成环状有机物E(C6H8O4)的流程如图:
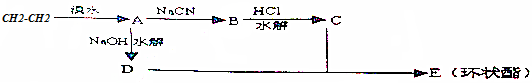
试写出A、B、C、D、E的结构简式.
4.已知常温下,0.1mol•L-1 CH3COONH4溶液呈中性.下列有关叙述正确的是( )
| A. | 该溶液可由等体积、浓度均为0.1mol•L-1的醋酸和氨水反应得到 | |
| B. | CH3COONH4加人纯水中,水的电离程度不变 | |
| C. | 常温下,电离平衡常数K(CH3COOH)=K(NH3•H2O) | |
| D. | 该溶液中c(CH3COO-)大于同浓度CH3COONa溶液中的c(CH3COO-) |
1.一定温度下,水溶液中H+和OH-的浓度变化曲线如图,下列说法正确的是( )
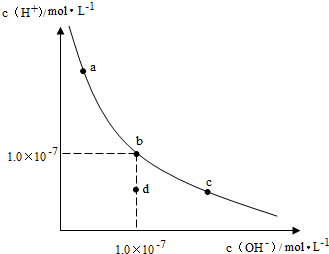

| A. | 升高温度,可能引起由c向b的变化 | |
| B. | 该温度下,水的离子积常数为1.0×10-13 | |
| C. | 该温度下,加入FeCl3可能引起由b向a的变化 | |
| D. | 该温度下,稀释溶液可能引起由c向d的变化 |
2.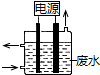 用如图所示装置除去含有CN-、Cl- 废水中的CN-时,控制溶液pH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法不正确的是( )
用如图所示装置除去含有CN-、Cl- 废水中的CN-时,控制溶液pH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法不正确的是( )
 用如图所示装置除去含有CN-、Cl- 废水中的CN-时,控制溶液pH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法不正确的是( )
用如图所示装置除去含有CN-、Cl- 废水中的CN-时,控制溶液pH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法不正确的是( )| A. | 用石墨作阳极,铁作阴极 | |
| B. | 阳极的电极反应式:Cl-+2OH--2e-═ClO-+H2O | |
| C. | 阴极的电极反应式:2H2O+2e-═H2↑+2OH- | |
| D. | 除去CN-的反应:2CN-+5ClO-+2H+═N2↑+2CO2↑+5Cl-+H2O |