题目内容
1.一定温度下,水溶液中H+和OH-的浓度变化曲线如图,下列说法正确的是( )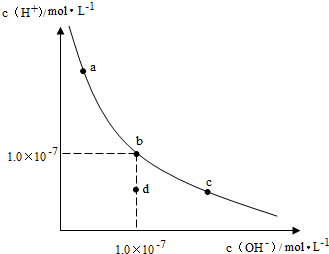
| A. | 升高温度,可能引起由c向b的变化 | |
| B. | 该温度下,水的离子积常数为1.0×10-13 | |
| C. | 该温度下,加入FeCl3可能引起由b向a的变化 | |
| D. | 该温度下,稀释溶液可能引起由c向d的变化 |
分析 A、由图可知abc为等温线;
B、由b点计算此温度下水的离子积常数为1.0×10-14;
C、b点到a点,氢离子浓度变大,氢氧根离子浓度减小,据此解答即可;
D、稀释不会引起水的离子积的改变,据此解答即可.
解答 解:A、由图可知abc三点对应的平衡常数不变,故abc为等温线,故升高温度,不能由c到b,故A错误;
B、b点c(H+)=c(OH-)=1.0×10-7,故KW=1.0×10-7×1.0×10-7=1.0×10-14,故B错误;
C、加入FeCl3,氯化铁为强酸弱碱盐,铁离子结合水电离出的氢氧根,促进水的电离平衡右移,即氢离子浓度增大,氢氧根离子浓度减小(由b到a),符合图象变化趋势,故C正确;
D、由c点到d点,水的离子积常数减小,温度不变,K不变,故不能利用稀释使其形成此变化,故D错误,
故选C.
点评 本题主要考查的是水的离子积常数以及水电离的影响因素,掌握水的离子积为温度的函数是解决本题的关键,难度不大.

练习册系列答案
相关题目
12.将1.800g FeC2O4•2H2O固体放在一个可称量的容器中加热,分解产物为CO、CO2、H2O与铁的氧化物,已知500℃时残留固体质量为0.800g,则此时所得气体的平均摩尔质量为( )
| A. | 25g/mol | B. | 27g/mol | C. | 30g/mol | D. | 32g/mol |
9.下列溶液中与1L 0.1mol•L-1 NaCl溶液混合,所得中c(Cl-)最大的是( )
| A. | 50mL 1mol•L-1 NaCl溶液 | B. | 20mL 2mol•L-1 AlCl3溶液 | ||
| C. | 30mL 1mol•L-1 MgCl2溶液 | D. | 100mL 3mol•L-1 NaClO3溶液 |
16.下列物质中,在一定条件下既能跟乙醇反应,又能跟乙酸反应的是( )
| A. | Cu | B. | CuO | C. | CaCO3 | D. | NaHCO3 |
10.下列关于自然界中氮循环(如图)的说法不正确的是( )
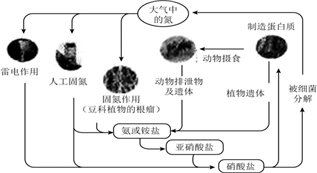

| A. | 氮元素均被氧化 | |
| B. | 工业合成氨属于人工固氮 | |
| C. | 含氮无机物和含氮有机物可相互转化 | |
| D. | 碳、氢、氧三种元素也参加了氮循环 |

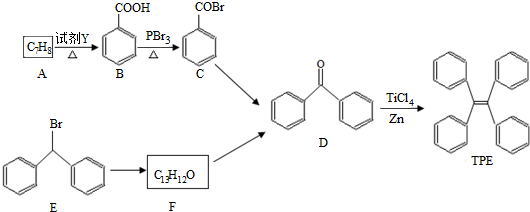
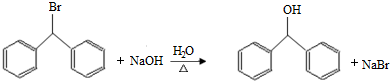 ;
;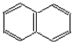 )的一元取代物;②存在羟甲基(-CH2OH),写出W所有可能的结构简式:
)的一元取代物;②存在羟甲基(-CH2OH),写出W所有可能的结构简式: ;
; .
.