题目内容
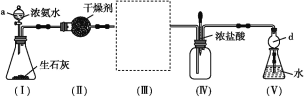
【题目】某校化学探究小组利用以下装置制取并探究氨气的性质。[已知生石灰与水反应生成Ca(OH)2并放出热量,实验室利用此原理往生石灰中滴加浓氨水,可以快速制取氨气。部分夹持仪器已略去]
(实验探究)
(1)装置(Ⅰ)中生石灰的化学式为________,仪器a的名称是_____。
(2)装置(Ⅱ)中的干燥剂可选用____(填“碱石灰”或“浓硫酸”)。
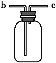
(3)在装置(Ⅲ)连接如图所示的装置,用于收集氨气(已知氨气的密度小于空气),氨气应从导管口_____(填“b”或“c”)通入集气瓶中。
(4)当实验进行一段时间后,挤压装置(Ⅳ)中的胶头滴管,滴入1~2滴浓盐酸,可观察到瓶内产生大量的______(填“白烟”或“白雾”),写出NH3与HCl反应的化学方程式:___________。
(5)装置(Ⅴ)中仪器d的作用是_______。取装置(Ⅴ)中的少量氨水于试管中,滴入1~2滴酚酞试液,溶液显____(填“无色”或“红色”),其原因是_______。
(知识应用)
(6)液氨可作制冷剂是由于液氨汽化时_____(填“吸收”或“放出”)大量的热,使周围环境的温度降低。
(7)氨气是工业制硝酸的原料,其第一步反应为4NH3+5O2![]() 4NO+6H2O,在该反应中氮元素的化合价____(填“升高”或“降低”),氨气表现出_____(填“氧化性”或“还原性”)。
4NO+6H2O,在该反应中氮元素的化合价____(填“升高”或“降低”),氨气表现出_____(填“氧化性”或“还原性”)。
【答案】CaO 分液漏斗 碱石灰 c 白烟 NH3+HCl=NH4Cl 防止溶液倒吸 红色 氨水显碱性(或NH3·H2O![]() NH4++OH-等) 吸收 升高 还原性
NH4++OH-等) 吸收 升高 还原性
【解析】
(1)装置(Ⅰ)中生石灰的化学名是氧化钙,化学式为CaO,仪器a的名称是分液漏斗。
答案为:CaO;分液漏斗;
(2)装置(Ⅱ)中的干燥剂为固体干燥剂,应选用碱石灰。
(3)在装置(Ⅲ)连接如图所示的装置,用于收集氨气(已知氨气的密度小于空气),氨气通入集气瓶中应该短进长出,进口为c。
答案为:c;
(4)当实验进行一段时间后,挤压装置(Ⅳ)中的胶头滴管,滴入1~2滴浓盐酸,浓盐酸具有挥发性,在瓶内与氨气化合生成氯化铵固体小颗粒,可观察到瓶内产生大量的白烟, NH3与HCl反应的化学方程式:NH3+HCl=NH4Cl。
答案为:白烟;NH3+HCl=NH4Cl
(5)氨气极易溶于水,会发生倒吸,装置(Ⅴ)中仪器d的作用是防止溶液倒吸。取装置(Ⅴ)中的少量氨水于试管中,滴入1~2滴酚酞试液,由于氨水是弱碱,溶液显碱性,与酚酞变红。
答案为:红色;氨水显碱性(或NH3·H2O![]() NH4++OH-等);
NH4++OH-等);
(6)液氨可作制冷剂是由于液氨汽化时吸收大量的热,使周围环境的温度降低。
答案为:吸收;
(7)氨气是工业制硝酸的原料,其第一步反应为4NH3+5O2![]() 4NO+6H2O,在该反应中氮元素的化合价-3价变为+2价,化合价升高,氨气是还原剂,表现出还原性。
4NO+6H2O,在该反应中氮元素的化合价-3价变为+2价,化合价升高,氨气是还原剂,表现出还原性。
答案为:升高;还原性

 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案【题目】如表是不同温度下水的离子积数据:
温度/℃ | 25 | t1 | t2 |
水的离子积(mol2·L-2) | 1×10-14 | a | 1×10-12 |
试回答以下问题:
(1)若25<t1<t2,则a___1×10-14 (填“>”、“<”或“=”![]() ,作此判断的理由是___。
,作此判断的理由是___。
(2)25℃下,某Na2SO4溶液中c(SO42-)=5×10-4mol·L-1,取该溶液1mL加水稀释至10mL,则稀释后溶液中c(Na+):c(OH-)=____。
(3)在t2℃下,pH=2的稀硫酸溶液中,水电离产生的H+浓度为c(H+)水=___
(4)t2℃下,将pH=11的苛性钠溶液V1L与pH=1的稀硫酸V2L(混合体积为原两溶液体积之和),所得混合溶液的pH=2,则V1∶V2=___,此溶液中各种离子的浓度由大到小的排列顺序:____。