题目内容
【题目】如表是不同温度下水的离子积数据:
温度/℃ | 25 | t1 | t2 |
水的离子积(mol2·L-2) | 1×10-14 | a | 1×10-12 |
试回答以下问题:
(1)若25<t1<t2,则a___1×10-14 (填“>”、“<”或“=”![]() ,作此判断的理由是___。
,作此判断的理由是___。
(2)25℃下,某Na2SO4溶液中c(SO42-)=5×10-4mol·L-1,取该溶液1mL加水稀释至10mL,则稀释后溶液中c(Na+):c(OH-)=____。
(3)在t2℃下,pH=2的稀硫酸溶液中,水电离产生的H+浓度为c(H+)水=___
(4)t2℃下,将pH=11的苛性钠溶液V1L与pH=1的稀硫酸V2L(混合体积为原两溶液体积之和),所得混合溶液的pH=2,则V1∶V2=___,此溶液中各种离子的浓度由大到小的排列顺序:____。
【答案】> 温度升高,水的电离程度增大,离子积增加 c(Na+):c(OH-)=1000︰1 1×10-10mol/L 9︰11 c(Na+)>c(SO42-)>c(H+)>c(OH-)
【解析】
(1)水是弱电解质,存在电离平衡,电离过程为吸热反应,温度升高,水的电离程度增大,导致水的离子积增大,所以a>1×1014,
故答案为:>;升高温度,水的电离程度增大,离子积增大;
(2)硫酸钠溶液中一定满足c(Na+):c(SO42)=2:1;硫酸钠溶液中c(Na+)![]() ,稀释后c(Na+)
,稀释后c(Na+)![]() ,溶液呈中性, c(OH)=1×107mol·L1,c(Na+):c(OH)=1×104mol·L1:1×107mol·L1=1000:1,
,溶液呈中性, c(OH)=1×107mol·L1,c(Na+):c(OH)=1×104mol·L1:1×107mol·L1=1000:1,
故答案为:1000:1;
(3)pH=2的硫酸中c(H+)=102mol/L,根据图表可知t2℃下,Kw=1×1012,c(OH)=![]() mol/L=1×1010mol/L,
mol/L=1×1010mol/L,
故答案为:1×1010mol/L;
(4)混合液的pH=2,酸过量,则c(H+)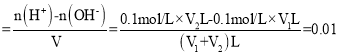 mol·L1,整理可得V1:V2=9:11,
mol·L1,整理可得V1:V2=9:11,
c(Na+)=![]() =0.045mol/L,c(SO42)=
=0.045mol/L,c(SO42)=![]() =0.0275mol/L,c(H+)=0.01mol/L,
=0.0275mol/L,c(H+)=0.01mol/L,
硫酸过量溶液显酸性,则(H+)>c(OH),则溶液中各种离子的浓度由大到小的排列顺序是:c(Na+)>c(SO42-)>c(H+)>c(OH-),
故答案为:9︰11; c(Na+)>c(SO42-)>c(H+)>c(OH-)。