题目内容
【题目】体NH4Br置于密闭容器中,在某温度下,发生反应:NH4Br(s)![]() NH3(g)+HBr(g),2HBr(g)
NH3(g)+HBr(g),2HBr(g)![]() Br2(g)+H2(g),2 min后,测知H2的浓度为0.5 mol·L-1,HBr的浓度为4 mol·L-1,若上述反应速率用v(NH3)表示,则下列速率正确的是( )
Br2(g)+H2(g),2 min后,测知H2的浓度为0.5 mol·L-1,HBr的浓度为4 mol·L-1,若上述反应速率用v(NH3)表示,则下列速率正确的是( )
A. 0.5 mol·L-1·min-1B. 2.5 mol·L-1·min-1
C. 2 mol·L-1·min-1D. 1.25 mol·L-1·min-1
【答案】B
【解析】
根据反应可知,溴化铵分解生成的氨气浓度与溴化氢浓度相等,溴化铵分解生成的溴化氢的浓度为:c(HBr)+2c(H2)=4mol/L+2×0.5mol/L=5mol/L,
所以2min后溴化铵分解生成的氨气的浓度为:c(NH3)=c总(HBr)=5mol/L,
氨气的平均反应速率为:![]() =2.5 mol/(Lmin),故选B。
=2.5 mol/(Lmin),故选B。
答案:B

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】下表是元素周期表中的一部分。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
1 | A | |||||||
2 | E | F | G | H | J | |||
3 | B | C | D | I |
根据A-J在周期表中的位置,用元素符号或化学式回答下列问题:
(1)化学性质最不活泼的元素是_________________,氧化性最强的单质是___________。
(2)常温常压下,1g A单质完全燃烧生成液态水时放出的热量为Q kJ,写出该反应的热化学方程式______________。
(3)B、G、I简单离子半径由大到小的顺序是____________。
(4)A、G、I形成有漂白性的化合物的电子式是___________。
(5)由A、F、G、H四种元素中的三种组成一种强酸,该强酸的稀溶液能与金属铜反应,该反应的化学方程式是___________________。
(6)B最高价氧化物对应的水化物与D最高价氧化物对应的水化物反应的离子方程式是_______。
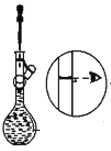
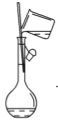
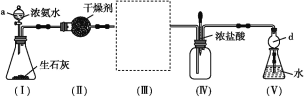
【题目】下图是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容。现用该浓硫酸配制480 mL0.2 molL-1的稀硫酸。可供选用的仪器有:①托盘天平;②烧瓶;③烧杯;④药匙;⑤量筒;⑥玻璃棒。

(1)配制稀硫酸时,还缺少的仪器有________________(写仪器名称),
(2)下图是某些仪器的刻度部分示意图,其中为量筒的是________(填编号)。配制稀硫酸需要用量筒量取上述浓硫酸的体积为________mL,量取硫酸时应选用________(填选项)规格的量筒。
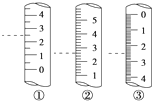
A.10mL B.50mL C.100mL D.200mL
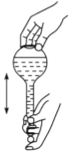
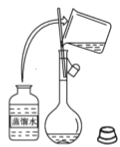
(3)下图为量取浓硫酸后配制稀硫酸的操作示意图,其正确的操作步骤为_______(填编号)。
|
|
|
|
|
|
① | ② | ③ | ④ | ⑤ | ⑥ |
(4)对所配制的稀硫酸进行测定,发现其浓度大于0.2 mol/L,引起该误差的原因可能是_____。
A.所用的浓硫酸长时间放置在密封不好的容器中
B.用量筒量取浓硫酸时,仰视刻度线取浓硫酸
C.容量瓶用蒸馏水洗涤后未干燥,含有少量蒸馏水
D.将稀释后的稀硫酸未冷却立即转入容量瓶后,紧接着就进行以后的实验操作
E.定容时,俯视容量瓶刻度线进行定容
【题目】下列对实验事实的解释错误的是( )
选项 | 实验事实 | 解释 |
A | 实验室用粗锌与稀盐酸反应制H2比纯锌快 | 粗锌与稀盐酸构成原电池 |
B | 浓硝酸保存在棕色试剂瓶中 | 4HNO3 |
C | 向10mL0.2mol·L-1ZnSO4,溶液中加入10mL0.4mol·L-1Na2S溶液,产生白色沉淀,再滴加CuSO4溶液,沉淀变黑 | Ksp(CuS)<Ksp(ZnS) |
D | 做过银镜反应的试管可用铁盐溶液洗涤,加入稀盐酸,清洗效果更好 | Fe3++Ag |
A.AB.BC.CD.D