题目内容
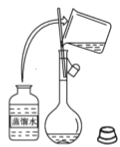
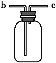
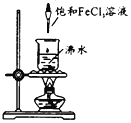
【题目】在沸水中逐滴加入5~6滴FeCl3饱和溶液,继续煮沸至溶液呈红褐色。下列正确的是
A.在暗处用激光笔照射液体,会出现一条光亮的通路
B.可用滤纸分离提纯得到氢氧化铁胶体
C.所得胶体中分散质的粒子直径大于100nm
D.取适量液体置于U型管,并通直流电,阳极颜色加深
【答案】A
【解析】
A.向沸水中滴人几滴饱和FeCl3溶液,继续煮沸,溶液变红褐色,得到氢氧化铁胶体,具有丁达尔效应,即用激光笔照射,会出现一条光亮的通路,故A正确;
B.氢氧化铁胶体的粒子直径为1~100nm,可以透过滤纸,不可用滤纸分离提纯得到氢氧化铁胶体,故B错误;
C.所得红褐色溶液为氢氧化铁胶体,粒子直径为1~100nm,故C错误;
D.因为氢氧化铁胶体粒子带正电,能发生电泳现象,即取适量氢氧化铁胶体液体置于U型管,并通直流电,阴极颜色加深,故D错误;
所以答案:A。

 字词句篇与同步作文达标系列答案
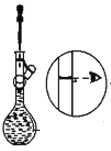
字词句篇与同步作文达标系列答案【题目】下图是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容。现用该浓硫酸配制480 mL0.2 molL-1的稀硫酸。可供选用的仪器有:①托盘天平;②烧瓶;③烧杯;④药匙;⑤量筒;⑥玻璃棒。

(1)配制稀硫酸时,还缺少的仪器有________________(写仪器名称),
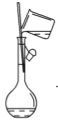
(2)下图是某些仪器的刻度部分示意图,其中为量筒的是________(填编号)。配制稀硫酸需要用量筒量取上述浓硫酸的体积为________mL,量取硫酸时应选用________(填选项)规格的量筒。
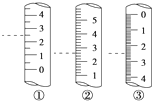
A.10mL B.50mL C.100mL D.200mL
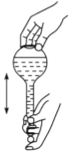
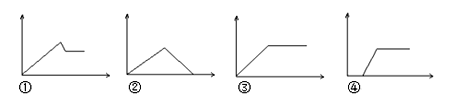
(3)下图为量取浓硫酸后配制稀硫酸的操作示意图,其正确的操作步骤为_______(填编号)。
|
|
|
|
|
|
① | ② | ③ | ④ | ⑤ | ⑥ |
(4)对所配制的稀硫酸进行测定,发现其浓度大于0.2 mol/L,引起该误差的原因可能是_____。
A.所用的浓硫酸长时间放置在密封不好的容器中
B.用量筒量取浓硫酸时,仰视刻度线取浓硫酸
C.容量瓶用蒸馏水洗涤后未干燥,含有少量蒸馏水
D.将稀释后的稀硫酸未冷却立即转入容量瓶后,紧接着就进行以后的实验操作
E.定容时,俯视容量瓶刻度线进行定容
【题目】下列对实验事实的解释错误的是( )
选项 | 实验事实 | 解释 |
A | 实验室用粗锌与稀盐酸反应制H2比纯锌快 | 粗锌与稀盐酸构成原电池 |
B | 浓硝酸保存在棕色试剂瓶中 | 4HNO3 |
C | 向10mL0.2mol·L-1ZnSO4,溶液中加入10mL0.4mol·L-1Na2S溶液,产生白色沉淀,再滴加CuSO4溶液,沉淀变黑 | Ksp(CuS)<Ksp(ZnS) |
D | 做过银镜反应的试管可用铁盐溶液洗涤,加入稀盐酸,清洗效果更好 | Fe3++Ag |
A.AB.BC.CD.D