题目内容
【题目】氮化硅(Si3N4)是一种新型陶瓷材料,它可以由石英与焦炭在高温下的氮气流中,通过以下反应制得:3SiO2(s) + 6C(s) +2N2(g)![]() Si3N4(s) +6CO(g)
Si3N4(s) +6CO(g)
(1)该反应的平衡常数表达式为K=___________________;
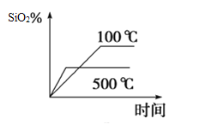
(2)不同温度下SiO2的平衡转化率随时间的变化如图所示,则该反应为___________反应(填“吸热”或“放热”);升高温度,其平衡常数值将___________(填“增大”“ 减小”或“不变”);
(3)已知反应达到平衡时,CO的生成速率为v (CO) =18 mol·L-1·min-1,则N2消耗速率为v(N2)=
____________mol·L-1·min-1。
(4)反应达到平衡时,压缩容器的体积,平衡将向________反应方向移动(填“正”或“逆”);
【答案】K=c6(CO)/c2(N2) 放热 减小 6 逆
【解析】
(1)可逆反应3SiO2(s)+6C(s)+2N2(g)Si3N4(s)+6CO(g)的平衡常数k=![]() ;
;
(2)不同温度下SiO2的平衡转化率随时间的变化如图所示,则升高温度二氧化硅的平衡转化率降低,平衡向逆反应方向移动,故该反应为放热反应;升高温度,平衡向逆反应方向移动,则其平衡常数值将减小;
(3)已知反应达到平衡时,正反应速率等于逆反应速率,且反应速率之比等于化学计量数之比,CO的生成速率与消耗速率均为v (CO) =18 mol·L-1·min-1,则N2消耗速率为v(N2)= ![]() v (CO) =
v (CO) =![]() 18 mol·L-1·min-1=6mol·L-1·min-1;
18 mol·L-1·min-1=6mol·L-1·min-1;
(4)反应达到平衡时,压缩容器的体积,相当于增大压强,平衡将向气体体积缩小逆反应方向移动。

练习册系列答案
 新编小学单元自测题系列答案
新编小学单元自测题系列答案 字词句段篇系列答案
字词句段篇系列答案
相关题目