题目内容
【题目】已知2SO2(g)+O2(g)![]() 2SO3(g),△H=-198kJ/mol,在 V2O5存在时反应过程中的能量变化如图所示。下列叙述正确的是
2SO3(g),△H=-198kJ/mol,在 V2O5存在时反应过程中的能量变化如图所示。下列叙述正确的是
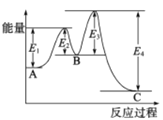
A. △H= E4- E3+E2-E1
B. 加入V2O5后反应经过两步完成,其中第一步决定反应速率
C. 加入V2O5,△H不变,但反应速率改变
D. 向密闭容器中充入2molSO2和1molO2,发生上述反应达平衡时,反应放热198kJ
【答案】C
【解析】
A.根据图示可知:反应的焓变为吸收能量与放出能量的差值,△H=E1-E2+E3-E4,A错误;
B.多步反应的反应速率由慢反应决定,由图可知:加入V2O5后第二步反应发生需要的能量高,反应速率慢,所以反应速率由第二步反应决定,B错误;
C.催化剂不能改变反应物、生成物的能量,所以△H不变,但催化剂能改变反应途径,所以使用催化剂后反应速率改变,C正确;
D.该反应是可逆反应,反应物不能完全转化为生成物,所以向密闭容器中充入2molSO2和1molO2,发生上述反应达平衡时,反应放热小于198kJ,D错误;
故合理选项是C。

练习册系列答案
相关题目