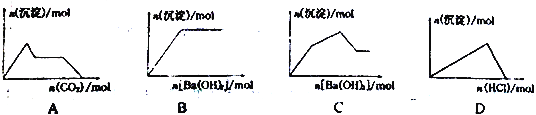��Ŀ����
����Ŀ����1��ʵ�����������KMnO4��Ũ���ᷴӦ��ȡ�������䷴Ӧ�����ӷ���ʽΪ�� ________
��2��ij�¶��£���Cl2ͨ��NaOH ��Һ�У���Ӧ�õ�����C1O-��C1O3-���ʵ���֮��Ϊ1: 1�Ļ��Һ��
��Ӧ�Ļ�ѧ����ʽ��________________________��
��3�������С���Ϊ2017 �궬������µ����в������Ƕ���Ҫ��ÿ��ÿ������á�84������Һ������
������֪ijƷ�ơ�84������Һ����Ч�ɷ�ΪNaClO��д�������Һ��ͨ�������CO2���������й����ӷ���ʽ________________________
��4����(CN) 2�Ļ�ѧ���ʺ�±��(X2) �����ƣ���ѧ�ϳ�Ϊ��±�ء���д��(CN)2��ˮ��Ӧ�Ļ�ѧ����ʽ�� _______
��5������Ч�Ⱥ��������������������������������������䶨���ǣ�ÿ�˺��������������������൱
�ڶ��ٿ�Cl2������������NaClO2����Ч�Ⱥ���Ϊ_________��(������������λС��)
���𰸡� 2MnO4-+10Cl-+16H+=2Mn2++5Cl2��+8H2O 4Cl2+8NaOH=6NaCl+NaClO3+NaClO+4H2O ClO-+CO2+H2O=HClO+HCO3- (CN)2+H2O=HCN+HCNO 1.57
����������1��ʵ�����������KMnO4��Ũ���ᷴӦ��ȡ��������Ӧ�����Ȼ��̡�������ˮ���䷴Ӧ�����ӷ���ʽΪ��2MnO4-+10Cl-+16H+=2Mn2++5Cl2��+8H2O����2��ij�¶��£���Cl2ͨ��NaOH ��Һ�У���Ӧ�õ�����C1O-��C1O3-���ʵ���֮��Ϊ1: 1�Ļ��Һ����Ӧ����Ԫ�ػ��ϼ���1+5=6�������ɵ��Ȼ�������Ԫ�ػ��ϼ۽�1��ϵ��Ϊ6����������غ�ɵã���Ӧ�Ļ�ѧ����ʽ��4Cl2+8NaOH=6NaCl+NaClO3+NaClO+4H2O����3��̼�������ǿ�ڴ����ᣬ��84������Һ��ͨ�������CO2���ɴ������̼�����ƣ���Ӧ�����ӷ���ʽΪ��ClO-+CO2+H2O=HClO+HCO3-����4����(CN) 2�Ļ�ѧ���ʺ�±��(X2) �����ƣ���ѧ�ϳ�Ϊ��±�ء� (CN)2��ˮ��Ӧ����HCN��HCNO�����Ļ�ѧ����ʽ��(CN)2+H2O=HCN+HCNO����5��1gNaClO2�����ʵ���![]() =
=![]() mol�����ݵ���ת����Ŀ��ȣ�NaClO2��Cl-��4e-��Cl2��2Cl-��2e-����֪���������ʵ���Ϊ
mol�����ݵ���ת����Ŀ��ȣ�NaClO2��Cl-��4e-��Cl2��2Cl-��2e-����֪���������ʵ���Ϊ![]() mol��4��
mol��4��![]() =
=![]() mol��������������Ϊ
mol��������������Ϊ![]() mol��71g/mol=1.57g��
mol��71g/mol=1.57g��