题目内容
【题目】过氧化钠保存不当在空气中容易变质。
(1)某过氧化钠样品已经部分变质,只限用一种溶液,请你设计一种简便的化学方法,证明过氧化钠已经变质。____________________________________________
(2)若用最简单的实验来检验样品中还有过氧化钠,除试管、胶头滴管等外还需用的实验用品有:____________________________________________
(3)某课外活动小组为了测定样品,他们称取ag样品,并设计用下图装置来测定过氧化钠的质量分数。(假设C中Na2O2完全反应)。实验过程记录如下: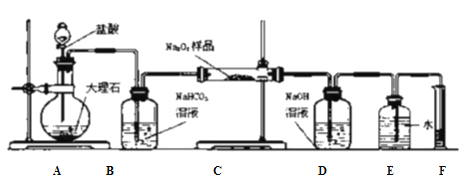
a.检查装置气密性;b.往玻璃管中放入a g样品,其它仪器中均加入足量的相应试剂,从分液漏斗往烧瓶中加入过量盐酸,立即发生剧烈反应,将广口瓶中的水排入量简中;c实验结束后,测量量筒中收集到的水的体积,进行计算。
①写出装置A和B中发生反应的离子方程式:
装置A:__________________________________;
装置B:____________________________________。
②他们在读出量筒内水的体积后,折算成标准状况下氧气的体积为VmL,则样品中过氧化钠的质量分数为______________________。
【答案】 取少量样品溶于水,滴加BaCl2溶液,若有白色沉淀生成,证明Na2O2已经变质 水、带火星的木条 CaCO3 + 2H+ = Ca2+ H2O+CO2↑ HCO3-+H+=H2O+CO2↑ ![]() %
%
【解析】(1)过氧化钠保存不当容易变质,生成Na2CO3,故检查过氧化钠是否变质,只需检验CO32-,故选用BaCl2溶液。方法为:取少量样品溶于水,滴加BaCl2溶液,若有白色沉淀生成,证明Na2O2已经变质;(2)若用最简单的实验来检验样品中还有过氧化钠,可利用与水反应产生氧气,通过检验氧气的产生得到结论,则除试管、胶头滴管等外还需用的实验用品有:水、带火星的木条;(3)①装置A中大理石与稀盐酸反应生成氯化钙、二氧化碳和水,发生反应的离子方程式为:CaCO3 + 2H+ = Ca2+ H2O+CO2↑;装置B中盐酸挥发的氢化氢与碳酸氢钠反应生成氯化钠、二氧化碳和水,发生反应的离子方程式为:HCO3-+H+=H2O+CO2↑;②测定出量筒内水的体积后,折算成标准状况下氧气的体积为VmL,则氧气物质的量=![]() ,2CO2+2Na2O2=2Na2CO3+O2,则过氧化钠的物质的量为2×
,2CO2+2Na2O2=2Na2CO3+O2,则过氧化钠的物质的量为2×![]() ;样品中过氧化钠的质量分数为=
;样品中过氧化钠的质量分数为=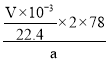 ×100%=
×100%=![]() %。
%。